
Amines struktur, egenskaber, typer, anvendelser, eksempler
Det aminer de er organiske forbindelser afledt af ammoniak. I dem er der kovalente bindinger mellem kulstof og nitrogen. Naturligvis er nitrogenmolekylet kinetisk inert; men takket være den biologiske fiksering omdannes den til ammoniak, som igen gennemgår efterfølgende alkyleringsreaktioner.
Når ammoniak er "alkyleret", erstatter det et, to eller tre af dets tre hydrogener med carbonatomer. Disse carbonatomer kan godt komme fra en alkyl (R) eller aryl (Ar) gruppe. Der er således alifatiske aminer (lineære eller forgrenede) og aromatiske.

Den generelle formel for alifatiske aminer er vist ovenfor. Denne formel kan anvendes til aromatiske aminer i betragtning af at R også kan være en arylgruppe Ar. Bemærk ligheden mellem amin og ammoniak, NH3. Praktisk talt er en H blevet erstattet af en R-sidekæde.
Hvis R består af alifatiske kæder, har du det, der er kendt som en alkylamin; mens hvis R er aromatisk i naturen, en arylamin. Af arylaminerne er den vigtigste af alt alanin: en aminogruppe, -NHto, bundet til benzenringen.
Når der er iltede grupper i en molekylær struktur, såsom OH og COOH, kaldes forbindelsen ikke længere en amin. I dette tilfælde betragtes aminen som en substituent: aminogruppen. For eksempel forekommer dette i aminosyrer såvel som i andre biomolekyler af enorm betydning for livet..
Da kvælstof findes i mange af de essentielle forbindelser for livet, blev de betragtet som vitale aminer; dvs. 'vitaminer'. Imidlertid er mange af vitaminerne ikke engang aminer, og desuden er det ikke alle, der er livsvigtige. Dette negerer imidlertid ikke dets store betydning i levende organismer..
Aminer er stærkere organiske baser end ammoniak i sig selv. De kan let ekstraheres fra plantemateriale og har generelt stærke interaktioner med organismernes neuronmatrix; derfor består mange lægemidler og lægemidler af aminer med komplekse strukturer og substituenter.
Artikelindeks
- 1 Struktur
- 2 Egenskaber ved aminer
- 2.1 Polaritet
- 2.2 Fysiske egenskaber
- 2.3 Opløselighed i vand
- 2.4 Grundlæggende
- 3 typer (primær, sekundær, tertiær)
- 4 Træning
- 4.1 Alkylering af ammoniak
- 4.2 Katalytisk hydrogenering
- 5 Nomenklatur
- 6 anvendelser
- 6.1 Farvestoffer
- 6.2 Narkotika og stoffer
- 6.3 Gasbehandling
- 6.4 Landbrugskemi
- 6.5 Fremstilling af harpikser
- 6.6 Animalske næringsstoffer
- 6.7 Gummiindustri
- 6.8 Opløsningsmidler
- 7 eksempler
- 7.1 Kokain
- 7.2 Nikotin
- 7.3 Morfin
- 7.4 Serotonin
- 8 Referencer
Struktur
Hvad er dens struktur? Selv om det varierer afhængigt af karakteren af R, er det elektroniske miljø for nitrogenatomet det samme for dem alle: tetraeder. Men da der er et par ikke-delte elektroner på nitrogenatomet (··), bliver molekylgeometrien pyramideformet. Dette er tilfældet med ammoniak og aminer.
Aminer kan repræsenteres af en tetraeder, ligesom carbonforbindelser. Således NH3 og CH4 er tegnet som tetraeder, hvor parret (··) er placeret ved en af hjørnerne over kvælstof.
Begge molekyler er achirale; dog begynder de at præsentere chiralitet, da deres H'er erstattes af R. Aminen RtoNH er achiral, hvis de to R'er er forskellige. Det mangler dog enhver konfiguration til at differentiere en enantiomer fra en anden (som det er tilfældet med chirale carboncentre).
Dette skyldes, at enantiomererne:
RtoN-H | H-NRto
de udveksles i en sådan hastighed, at ingen af dem kan isolere sig; og derfor betragtes aminstrukturerne som achirale, selvom alle substituenterne på nitrogenatomet er forskellige.
Egenskaber ved aminer
Polaritet
Aminer er polære forbindelser, da aminogruppen NHto, ved at have et elektronegativt nitrogenatom bidrager det til molekylets dipolmoment. Bemærk, at kvælstof har evnen til at donere hydrogenbindinger, hvilket får aminer til generelt at have høje kogepunkter og smeltepunkter..
Når denne egenskab imidlertid sammenlignes med iltede forbindelser, såsom alkoholer og carboxylsyrer, resulterer de i lavere størrelser..
F.eks. Kogepunktet for ethylamin, CH3CHtoNHto (16,6 ° C) er lavere end for ethanol, CH3CHtoOH (78ºC).
Således er det vist, at O-H-hydrogenbindinger er stærkere end N-H's, selvom en amin kan danne mere end en bro. Denne sammenligning er kun gyldig, hvis R har den samme molekylvægt for de to forbindelser (CH3CHto-). På den anden side koger etan ved -89ºC, CH3CH3, at være en gas ved stuetemperatur.
Da en amin har mindre brint, danner den færre hydrogenbindinger, og kogepunktet sænkes. Dette ses ved at sammenligne kogepunktet for dimethylamin, (CH3)toNH (7 ° C) med den for ethylamin (16,6 ° C).
Fysiske egenskaber
I kemiens verden, når du taler om en amin, opstår den ufrivillige handling at holde din næse. Dette skyldes, at de generelt har en ubehagelig lugt, hvoraf nogle ligner den hos rådne fisk..
Derudover har flydende aminer tendens til at have gule toner, hvilket øger den visuelle mistillid, de genererer..
Vandopløselighed
Aminer har tendens til at være uopløselige i vand, på trods af at de er i stand til at danne hydrogenbindinger med HtoEller dens vigtigste organiske komponent er hydrofob. Jo større eller længere R-grupperne er, jo lavere er deres opløselighed i vand..
Når der er en syre i mediet, forøges opløseligheden imidlertid ved dannelsen af såkaldte aminsalte. I dem har nitrogen en positiv delvis ladning, som elektrostatisk tiltrækker syrenes anion eller konjugatbase..
For eksempel i en fortyndet opløsning af HCI, aminen RNHto reagerer som følger:
RNHto + HCI => RNH3+Cl- (primært salt af amin)
RNHto Det var uopløseligt (eller let opløseligt) i vand, og i nærvær af syren danner det et salt, hvis opløsning af dets ioner favoriserer dets opløselighed.
Hvorfor sker dette? Svaret ligger i en af de vigtigste egenskaber ved aminer: de er polære og basale. Da de er basiske, vil de reagere med syrer, der er stærke nok til at protonere dem, ifølge Brönsted-Lowry-definitionen..
Grundlæggende
Aminer er stærkere organiske baser end ammoniak. Jo højere elektrondensiteten omkring nitrogenatomet, jo mere basisk vil den være; det vil sige, at det hurtigere deprotonerer syrene i miljøet. Hvis aminen er meget basisk, kan den endda stjæle protonen fra alkoholer.
R-grupperne bidrager med elektrondensitet til nitrogen ved induktiv effekt; siden må vi ikke glemme, at det er et af de mest elektronegative atomer, der findes. Hvis disse grupper er meget lange eller omfangsrige, vil den induktive effekt være større, hvilket også vil øge den negative region omkring elektronparet (··).
Dette får (··) til at acceptere H ion hurtigere+. Men hvis R er meget omfangsrig, falder grundlæggende på grund af den steriske effekt. Hvorfor? Af den enkle grund, at H+ skal krydse en konfiguration af atomer, inden de når nitrogen.
En anden måde at begrunde grundlæggelsen af en amin på er ved at stabilisere dets aminsalt. Nu kan den, der falder ved induktiv effekt, nedsætte den positive ladning N+, det vil være en mere grundlæggende amin. Årsagerne er de samme lige forklaret.
Alkylaminer vs arylaminer
Alkylaminer er meget mere basale end arylaminer. Hvorfor? For at forstå det enkelt vises strukturen af anilin:
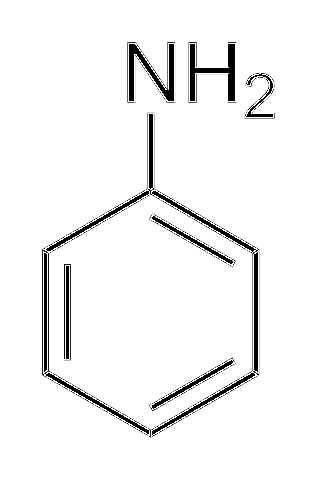
Ovenfor, i aminogruppen, er paret elektroner (··). Dette par "bevæger sig" inde i ringen i ortho og para positioner med hensyn til NHto. Det betyder, at de to øverste hjørner og det modsatte af NHto er negativt ladede, mens nitrogenatomet positivt.
Da kvælstof er positivt ladet, +N, vil afvise H-ionen+. Og hvis dette ikke er nok, delokaliseres elektronparret i den aromatiske ring, hvilket gør det mindre tilgængeligt for deprotonatsyrer..
Basiciteten af anilin kan øges, hvis grupper eller atomer, der giver den elektroniske densitet, er knyttet til ringen, der konkurrerer med parret (··) og tvinger det til at placeres med større sandsynlighed på nitrogenatomet, klar til at fungere som en base.
Typer (primær, sekundær, tertiær)

Selvom det ikke formelt er præsenteret, er der implicit blevet henvist til primære, sekundære og tertiære aminer (øverste billede, venstre mod højre).
Primære aminer (RNHtoer de monosubstituerede; de sekundære (RtoNH), er disubstitueret med to R-alkyl- eller arylgrupper; og de tertiære (R3N), er trisubstitueret og mangler hydrogen.
Alle eksisterende aminer stammer fra disse tre typer, så deres mangfoldighed og interaktion med den biologiske og neuronale matrix er enorm.
Generelt kunne tertiære aminer forventes at være de mest basale; Imidlertid kan en sådan erklæring ikke afgives uden at kende strukturer for R.
Uddannelse
Ammoniakalkylering
Først blev det nævnt, at aminer stammer fra ammoniak; derfor er den enkleste måde at danne dem på ved at alkylere dem. For at gøre dette omsættes et overskud af ammoniak med et alkylhalogenid efterfulgt af tilsætningen af en base for at neutralisere aminsaltet:
NH3 + RX => RNH3+x- => RNHto
Bemærk, at disse trin fører til en primær amin. Sekundære og endda tertiære aminer kan også dannes, så udbyttet for et enkelt produkt falder.
Nogle træningsmetoder, såsom Gabrielsyntesen, gør det muligt at opnå primære aminer, så andre uønskede produkter ikke dannes.
Også ketoner og aldehyder kan reduceres i nærvær af ammoniak og primære aminer for at give anledning til sekundære og tertiære aminer..
Katalytisk hydrogenering
Nitroforbindelser kan reduceres i nærvær af hydrogen og en katalysator til deres tilsvarende aminer.
ArNOto => ArNHto
Nitriler, RC≡N og amider, RCONRto, reduceres også for at give henholdsvis primære og tertiære aminer.
Nomenklatur
Hvordan navngives aminer? Det meste af tiden navngives de baseret på R, alkyl- eller arylgruppen. Til navnet R, der stammer fra dets alkan, tilføjes ordet 'amin' i slutningen.
CH3CHtoCHtoNHto er propylamin. På den anden side kan den navngives kun under hensyntagen til alkanen og ikke som en R-gruppe: propanamin.
Den første måde at navngive dem på er langt den mest kendte og mest anvendte.
Når der er to NH-grupperto, alkanen er navngivet, og aminogruppernes positioner er anført. Således er HtoNCHtoCHtoCHtoCHtoNHto kaldes: 1,4-butandiamin.
Hvis der er iltede grupper, såsom OH, bør det prioriteres over NHto, som tilfældigvis er navngivet som en substituent. For eksempel HOCHtoCHtoCHtoNHto Det kaldes: 3-aminopropanol.
Og med hensyn til sekundære og tertiære aminer bruges bogstaverne N til at angive R-grupperne. Den længste kæde forbliver med navnet på forbindelsen. Således er ch3NHCHtoCH3 Det kaldes: N-methylethylamin.
Ansøgninger
Farvestoffer
Primære aromatiske aminer kan tjene som udgangsmateriale til azofarvestofsyntese. Oprindeligt reagerer aminer for at danne diazoniumsalte, som danner azoforbindelser gennem azokobling (eller diazo-kobling)..
Disse, på grund af deres intense farve, bruges i tekstilindustrien som et farvningsmateriale; for eksempel: methyl orange, direkte brun 138, solnedgang gul FCF og ponceau.
Narkotika og stoffer
Mange lægemidler arbejder med agonister og antagonister til naturlige amin-neurotransmittere. Eksempler:
-Chloropheniramin er et antihistamin, der anvendes til kontrol af allergiske processer på grund af indtagelse af nogle fødevarer, høfeber, insektbid osv..
-Chlorpromazin er et beroligende middel og ikke et søvnfremkaldende middel. Lindrer angst og bruges endda til behandling af nogle psykiske lidelser.
-Efedrin og phenylephedrin anvendes som luftvejsafskillende midler.
-Amitriptylin og imipramin er tertiære aminer, der anvendes til behandling af depression. På grund af deres struktur klassificeres de som tricykliske antidepressiva..
-Opioide smertestillende midler såsom morfin, codeline og heroin er tertiære aminer.
Gasbehandling
Flere aminer, herunder diglycolamin (DGA) og diethanolamin (DEA), anvendes til eliminering af kuldioxid (COto) og hydrogensulfid (HtoS) findes i naturgas og raffinaderier.
Landbrugskemi
Methylaminer er mellemprodukter i syntesen af kemikalier, der anvendes i landbruget som herbicider, fungicider, insekticider og biocider.
Harpiksfremstilling
Methylaminer anvendes under produktionen af ionbytterharpikser, der kan bruges til deionisering af vand.
Animal Næringsstoffer
Trimethylamin (TMA) anvendes primært til produktion af cholinchlorid, et vitamin B-supplement, der anvendes til foder til kyllinger, kalkuner og svin..
Gummiindustrien
Dimethylaminoleat (DMA) er et emulgator til anvendelse i produktionen af syntetisk gummi. DMA bruges direkte som et polymeriseringsmodificerende middel i dampfasen af butadien og som en stabilisator for naturgummilatex i stedet for ammoniak
Opløsningsmidler
Dimethylamin (DMA) og monomethylamin (MMA) bruges til at syntetisere de aprote polære opløsningsmidler dimethylformamid (DMF), dimethylacetamid (DMAc) og n-methylpyrrolidon (NMP).
Ansøgninger om DMF inkluderer: urethancoating, acrylgarnopløsningsmiddel, reaktionsopløsningsmidler og ekstraktionsopløsningsmidler.
DMAc anvendes til fremstilling af garnfarvestoffer og opløsningsmiddel. Endelig anvendes NMP til raffinering af smøreolier, malingstripper og emaljebelægning..
Eksempler
Kokain
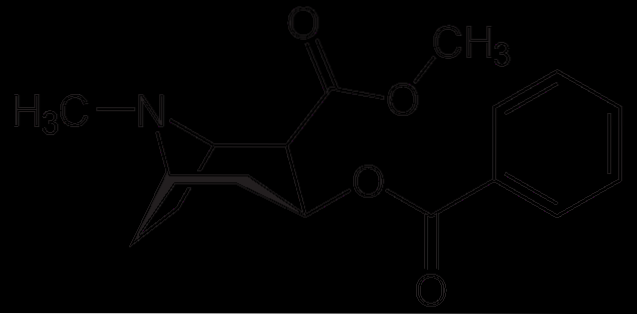
Kokain bruges som lokalbedøvelse i visse typer øjen-, øre- og halsoperationer. Som det ses er det en tertiær amin.
Nikotin

Nikotin er det primære middel til tobaksafhængighed, og kemisk er det en tertiær amin. Nikotinen i tobaksrøg absorberes hurtigt og er meget giftig.
Morfin
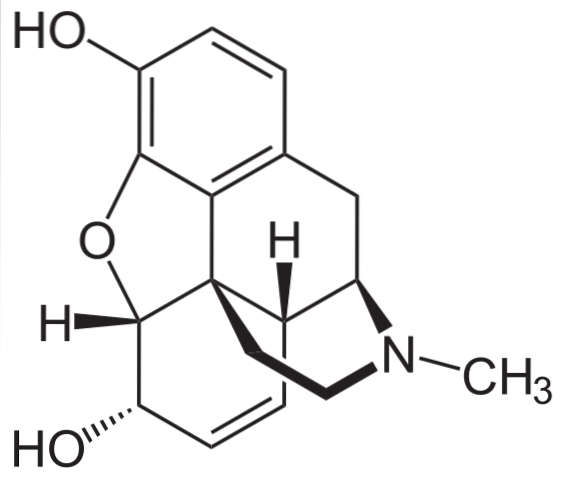
Det er en af de mest effektive smertestillende midler til at lindre smerter, især kræft. Det er igen en tertiær amin.
Serotonin

Serotonin er en amin-neurotransmitter. Hos deprimerede patienter nedsættes koncentrationen af hovedmetabolitten af serotonin. I modsætning til de andre aminer er denne primær.
Referencer
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kemi. (Femte udgave). Addison-Wesley Iberoamericana.
- Chemours Company. (2018). Methylaminer: anvendelser og applikationer. Gendannet fra: chemours.com
- Markedsundersøgelse om gennemsigtighed. (s.f.). Aminer: vigtige fakta og anvendelser. Gendannet fra: transparensmarketresearch.com
- Wikipedia. (2019). Amine. Gendannet fra: en.wikipedia.org
- Ganong, W. F. (2003). Medicinsk fysiologi. 19. udgave. Editorial The Modern Manual.


Endnu ingen kommentarer