
Benzen historie, struktur, egenskaber, derivater, anvendelser
Det benzen Det er en organisk forbindelse, der består af en af de enkleste aromatiske kulbrinter. Dens kemiske formel er C6H6, hvoraf det er kendt, at forholdet mellem carbon og hydrogen er lig med 1; for hvert kulstof er der et hydrogen bundet til det.
Selvom dets fysiske udseende er som en farveløs væske, findes den naturligt i olie og olieprodukter. Dens lugt er meget karakteristisk, da den ligner en blanding af lim, bitumen og benzin; på den anden side er det en flygtig og brandfarlig væske.

Billedet ovenfor viser en beholder eller flaske med benzen, formodentlig af ikke-analytisk renhed. Hvis de afdækkes, spredes benzendampene straks i hele laboratoriet. Af denne grund håndteres denne væske, der almindeligvis anvendes som et simpelt opløsningsmiddel, i en stinkskab..
At være dens formel C6H6, kemikere fra det 19. århundrede foreslog adskillige mulige strukturer, der ville svare til nævnte C / H-forhold svarende til 1. Ikke kun dette, men benzenmolekylet måtte have specielle bindinger på en sådan måde, at dets usædvanlige stabilitet mod additionsreaktioner kunne forklares; typisk for alkener og polyener.
Det var således, at deres forbindelser repræsenterede en gåde for datidens kemikere; indtil ejendommen kaldte aromatiske egenskaber. Før det betragtes som en hexacyclotrien (med tre C = C-bindinger), er benzen meget mere end det, og det er et andet af de mange eksempler på synergi inden for kemi.
I organisk kemi er benzen et klassisk symbol, det strukturelle grundlag for flere polyaromatiske forbindelser. Uendelige derivater opnås fra dets hexagon via aromatisk elektrofil substitution; en ring fra hvis kanter den struktur, der definerer nye forbindelser, er vævet.
Faktisk skyldes dets derivater de store industrielle anvendelser, som de har brug for benzen som deres råmateriale. Fra fremstilling af lim og tekstilfibre til plast, gummi, pigmenter, stoffer og sprængstoffer. På den anden side findes benzen naturligt i vulkaner, skovbrande, benzin og i cigaretrøg..
Artikelindeks
- 1 Historie
- 1.1 Opdagelse og navne
- 1.2 Industriproduktion
- 1.3 Historiske strukturer
- 2 Struktur af benzen
- 2.1 Resonans
- 2.2 Krystaller
- 3 egenskaber
- 3.1 Molekylær masse
- 3.2 Fysisk udseende
- 3.3 Kogepunkt
- 3.4 Smeltepunkt
- 3.5 Flammepunkt
- 3.6 Selvantændelsestemperatur
- 3.7 Densitet
- 3.8 Opløselighed
- 3.9 Dampmassefylde
- 3.10 Damptryk
- 3.11 Forbrændingsvarme
- 3.12 Fordampningsvarme
- 3.13 overfladespænding
- 3.14 Brydningsindeks
- 4 Derivater
- 5 anvendelser
- 6 Nomenklatur
- 7 Toksicitet
- 8 Referencer
Historie
Opdagelse og navne
Dens opdagelse dateres tilbage til 1825, som regel tilskrives Michael Faraday, da han samlede og eksperimenterede med et resterende olieprodukt af den gas, der blev brugt til belysning. Denne væske indeholdt et C / H-forhold tæt på 1, hvorfor han kaldte det 'karbureret brint'.
Kemiker Auguste Laurent kaldte det mærkelige carbonhydrid 'pheno', afledt af det græske ord 'phaínein'hvilket betyder lyst (fordi det blev opnået efter gassen brændte). Imidlertid blev dette navn ikke accepteret af det videnskabelige samfund og dominerede kun som 'phenyl' for at henvise til det radikale, der stammer fra benzen.
Fra benzoin tyggegummi lykkedes kemikeren Eilhard Mitscherlich, ni år senere, at producere den samme forbindelse; Derfor var der en anden kilde til det samme kulbrinte, som han døbte som 'benzin'. Imidlertid overvejede de heller ikke det passende navn, forudsat at det var et alkaloid, såsom kinin..
Således erstattede de navnet 'benzin' med 'benzol'. Imidlertid var der igen modsætninger og uoverensstemmelser som følge af, at udtrykket 'benzol' forvekslede carbonhydridet med en alkohol. Det var da, at navnet 'benzen' blev født, først brugt i Frankrig og England..
Industriel produktion
Hverken belysningsgas eller benzoingummi var egnede kilder til generering af benzen i stor skala. Charles Mansfield, der arbejdede sammen med August Wilhelm von Hofmann, lykkedes i 1845 at isolere benzen (tyve år efter opdagelsen) fra kultjære, et biprodukt fra koksproduktion..
Sådan begyndte den industrielle produktion af benzen fra kultjære. Tilgængeligheden af benzen i massive mængder letter studiet af dets kemiske egenskaber og tillod det at være relateret til andre forbindelser med lignende reaktiviteter. August Wilhelm von Hofmann opfandt selv ordet 'aromatisk' for benzen og beslægtede forbindelser.
Historiske strukturer
August Kekulés drøm
Friedrich August Kekulé tilskrives den sekskantede og cykliske struktur af benzen omkring året 1865, der stammer fra en mærkelig drøm med Uroboros, slangen, der bider sin egen hale ved at tegne en cirkel. Således mente han, at benzen kunne betragtes som en sekskantet ring, og andre kemikere foreslog mulige strukturer, som er vist nedenfor:

Nogle af de højere strukturer kunne tage højde for stabiliteten af benzen.
Bog, ringe og prisme
Bemærk, at den tredje struktur ikke engang er en ring, men et trekantet prisme, foreslået af Albert Ladenburg i 1869; til venstre for ham, en i form af en åben bog, foreslået af Sir James Dewar i 1867; og til højre, en med alle hydrogenerne rettet mod centrum af ringen, foreslået af Henry Edward Armstrong i 1887.
Den første struktur, foreslået af Adolf Karl Ludwig Claus i 1867, er også ret ejendommelig, da C-C-forbindelserne krydses. Og den sidste var Kekulés "serpentinske" ring, drømt om i 1865.
Hvad var "vinderen"? Den femte struktur (fra venstre mod højre), foreslået i 1899 af Johannes Thiele.
I denne undersøgelse blev resonanshybrid overvejet for første gang, som kombinerede de to Kekulé-strukturer (drej den første ring til højre for at observere den) og forklarede ekstraordinært delokaliseringen af elektroner og dermed den indtil da usædvanlige stabilitet af benzen.
Struktur af benzen
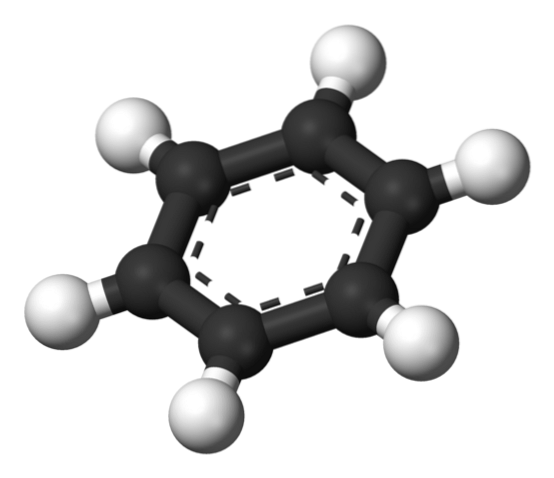
Ovenfor er den struktur, der er foreslået af Thiele ved hjælp af en model af kugler og stænger..
Benzenmolekylet er fladt, med hydrogenatomer, der peger udad fra siderne af ringen. Alle kulstofatomer har SP-hybridiseringto, med en orbital s tilgængelige for at etablere det aromatiske system, hvor seks elektroner delokaliseres.
Disse kulstoffer spto er mere elektronegative end hydrogener, og derfor trækker førstnævnte elektronisk densitet til sidstnævnte (Csp2δ--Hδ+). Derfor har midten af ringen en højere koncentration af elektroner end dens sider..
Mere præcist kan det aromatiske system repræsenteres som en elektronisk sky eller pude udvidet på begge sider af den sekskantede ring; og i midten, ved siderne eller kanterne, en elektronisk mangel, der består af hydrogener med en positiv delvis ladning.
Takket være denne fordeling af elektriske ladninger kan benzenmolekyler interagere med hinanden gennem dipol-dipolkræfter; H-atomerδ+ tiltrækkes af duftcentret i en nærliggende ring (dette vil blive vist nedenfor).
De aromatiske centre kan også stables oven på hinanden for at favorisere induktion af de øjeblikkelige dipoler..
Resonans

De to Kekulé-strukturer vises øverst på billedet og under dem resonanshybrid. Da de to strukturer forekommer igen og igen på samme tid, er hybrid repræsenteret af en cirkel tegnet i midten (svarende til en "sekskantet doughnut").
Hybridcirklen er vigtig, fordi den indikerer den aromatiske karakter af benzen (og den for mange andre forbindelser). Desuden påpeger han, at linkene ikke er så lange som C-C, og de er heller ikke så korte som C = C; men længden af det samme er mellem begge ekstremer. Således betragtes benzen ikke som polyen.
Det førnævnte er blevet demonstreret ved at måle længderne af C-C obligationer (139 pm) benzen, som er lidt mere aflange end C-H obligationer (109 pm).
Krystaller
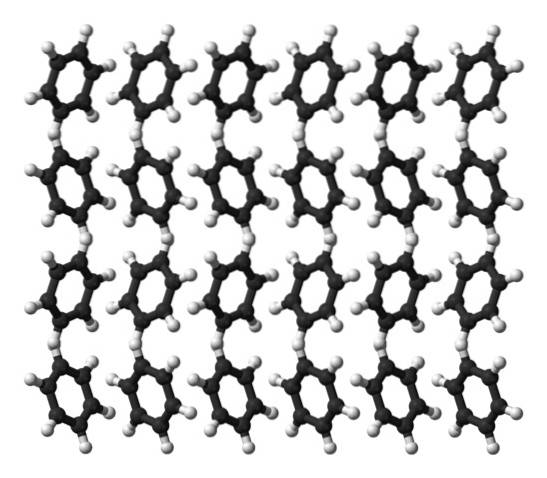
Benzen er en væske ved stuetemperatur. Dens intermolekylære kræfter betyder, at den til trods for ikke at have et så udtalt dipolmoment kan holde sine molekyler sammen i en væske, der koger ved 80 ° C. Når temperaturen falder til under 5 ° C, begynder benzen at fryse: og derved opnås dens tilsvarende krystaller..
Benzenringe kan vedtage definerede strukturelle mønstre i deres faste. Deres dipoler får dem til at "vippe" til venstre eller højre og danne rækker, der kan reproduceres af en orthorhombisk enhedscelle. Således er benzenkrystaller orthorhombiske.
Bemærk i det øverste billede, at ringens vipning favoriserer interaktionerne mellem Hδ+ og aromatiske centre, nævnt i tidligere underafsnit.
Ejendomme
Molekylær masse
78,114 g / mol.
Fysisk fremtoning
Farveløs væske med en benzinlignende lugt.
Kogepunkt
80 ° C.
Smeltepunkt
5,5 ºC.
antændelsespunkt
-11ºC (lukket kop).
Selvantændelsestemperatur
497,78ºC.
Massefylde
0,8765 g / ml ved 20 ° C.
Opløselighed
En liter kogende vand kan næppe opløse 3,94 g benzen. Dens ikke-polære karakter gør det praktisk talt blandbart med vand. Det er dog blandbart med andre opløsningsmidler, såsom ethanol, ethere, acetone, olier, chloroform, carbontetrachlorid osv..
Dampmassefylde
2.8 i forhold til luft (dvs. næsten tre gange så tæt).
Damptryk
94,8 mm Hg ved 25 ° C.
Forbrændingsvarme
-3267,6 kJ / mol (for flydende benzen).
Fordampningsvarme
33,83 kJ / mol.
Overfladespænding
28,22 mN / m ved 25 ° C.
Brydningsindeks
1.5011 ved 20 ° C.
Derivater
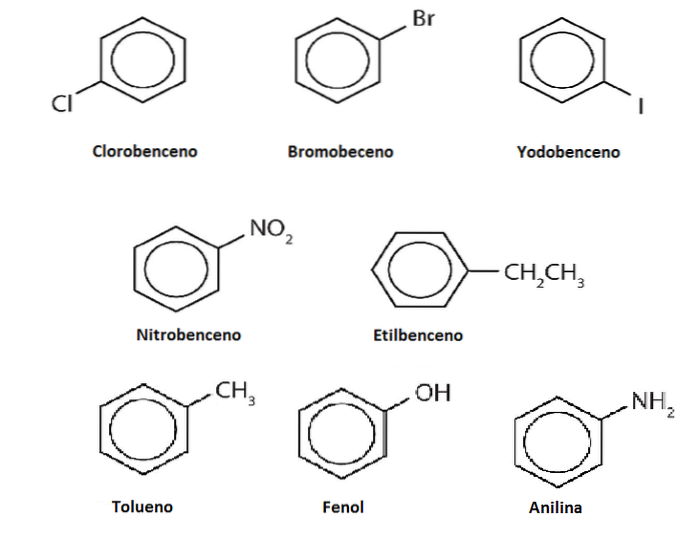
Hydrogenerne fra benzen kan erstattes af andre grupper eller atomer. Der kan være en eller flere substitutioner, hvilket øger substitutionsgraden, indtil ingen af de oprindelige seks hydrogener er tilbage.
Antag for eksempel benzen som Ph-H, hvor H er et af dets seks hydrogener. Husk at midten af ringen har en højere elektrondensitet, det tiltrækker elektrofiler, som angriber ringen for at erstatte H i en reaktion kaldet elektrofil aromatisk substitution (SEAr).
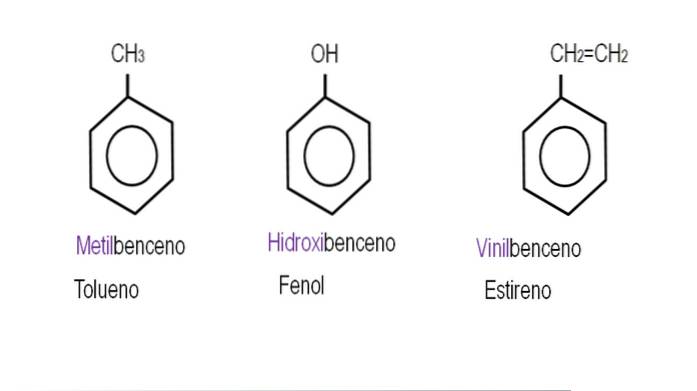
Hvis dette H erstattes af en OH, har vi Ph-OH, phenol; bliver erstattet af en CH3, Ph-CH3, toluen; hvis det er NHto, Ph-NHto, anilin; eller hvis det er CHtoCH3, Ph-CHtoCH3, ethylbenzen.
Derivaterne kan være de samme eller mere toksiske end benzen, eller tværtimod kan de blive så komplekse, at de har en ønskelig farmakologisk virkning..
Ansøgninger
Det er et godt opløsningsmiddel til en lang række forbindelser, der for eksempel findes i maling, lak, klæbemiddel og belægning.
Det kan også opløse olier, fedt eller voks, hvorfor det er blevet brugt som et ekstraherende opløsningsmiddel til essenser. Denne egenskab blev brugt af Ludwig Roselius i 1903 til koffeinfri kaffe, en operation, der ikke længere er i brug på grund af benzenens toksicitet. Ligeledes blev det tidligere brugt til affedtning af metaller.
I en af sine klassiske anvendelser fungerer den ikke som et opløsningsmiddel, men som et additiv: øger oktantalet benzin og erstatter bly til dette formål..
Derivater af benzen kan have forskellige anvendelser; nogle fungerer som pesticider, smøremidler, rengøringsmidler, plast, sprængstoffer, parfume, farvestoffer, lim, stoffer osv. Hvis en benzenring observeres i dens struktur, er det meget sandsynligt, at dens syntese er startet fra benzen.
Blandt dens vigtigste derivater er: cumen, xylen, anilin, phenol (til syntese af phenolharpikser), benzoesyre (konserveringsmiddel), cyclohexan (til syntese af nylon), nitrobenzen, resorcinol og ethylbenzen.
Nomenklatur
Nomenklaturen for benzenderivater varierer afhængigt af graden af substitution, hvad substituentgrupperne er og deres relative positioner. Således kan benzen gennemgå mono-, di-, tri-, tetra- osv. Substitutioner
Når de to grupper er fastgjort til tilstødende kulstoffer, anvendes betegnelsen 'ortho'; hvis der er et kulstof imellem at adskille dem, 'meta'; og hvis kulstofferne er i modsatte position, 'para'.
Billederne nedenfor viser eksempler på benzenderivater med deres respektive navne styret af IUPAC. De ledsages også af almindelige eller traditionelle navne.
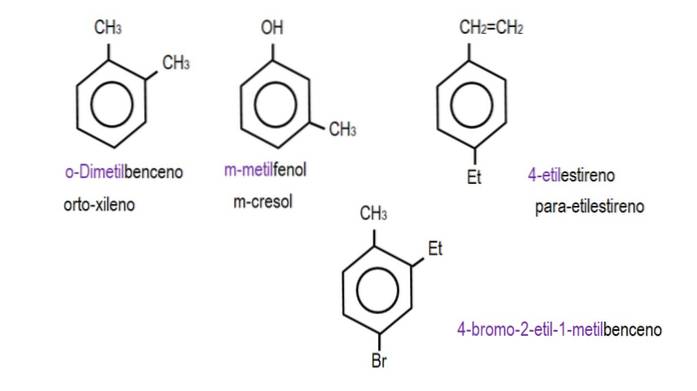
Bemærk, at i trisubstitueret benzen er ortho-, para- og meta-indikatorerne ikke længere nyttige..
Toksicitet
Benzen er en forbindelse, der skal håndteres med forsigtighed. På grund af sin særlige lugt kan de øjeblikkelige negative virkninger være kvælning, svimmelhed, hovedpine, rysten, døsighed, kvalme og endda døden (med høj eksponering). Hvis det indtages ud over det ovennævnte, kan det forårsage alvorlige mavesmerter og kramper..
Derudover er de langsigtede virkninger under konstant eksponering for denne væske kræftfremkaldende; øger chancerne for, at individet vil lide af en eller anden form for kræft, især blodkræft: leukæmi.
I blodet kan det nedsætte koncentrationen af røde blodlegemer, forårsage anæmi, og også påvirke knoglemarv og lever, hvor det assimileres af kroppen til at generere endnu mere giftige benzenderivater; for eksempel hydroxyquinon. Det akkumuleres også i nyrerne, hjertet, lungerne og hjernen..
Referencer
- Morrison, R.T. og Boyd, R. N. (1987). Organisk kemi. (5. udgave). Addison-Wesley Iberoamericana.
- Carey, F. A. (2008). Organisk kemi. (6. udgave). McGraw-Hill, Interamerica, Editores S.A.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- National Center for Biotechnology Information. (2019). Benzen. PubChem-database. CID = 241, Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Benzen. Gendannet fra: en.wikipedia.org
- Garcia Nissa. (2019). Hvad er benzen? - Anvendelse, struktur og formel. Undersøgelse. Gendannet fra: study.com
- Center for sygdomsbekæmpelse og forebyggelse. (4. april 2018). Fakta om benzen. Gendannet fra: emergency.cdc.gov
- Verdens Sundhedsorganisation. (2010). Eksponering for benzen: et stort folkesundhedsmæssigt problem. [PDF]. Gendannet fra: who.int
- Fernández Germán. (s.f.). Benzen nomenklatur problemer. Organisk kemi. Gendannet fra: quimicaorganica.org



Endnu ingen kommentarer