
Ideel gas lov formel og enheder, applikationer, eksempler
Det ideel gaslov er en tilstandsligning, der beskriver et forhold mellem de tilstandsfunktioner, der er forbundet med den ideelle gas; såsom temperatur, tryk, volumen og antal mol. Denne lov gør det muligt at studere ægte gasformige systemer ved at sammenligne dem med deres idealiserede versioner..
En ideel gas er en teoretisk gas, der består af punkt- eller sfæriske partikler, der bevæger sig tilfældigt; med stor kinetisk energi, hvor den eneste interaktion mellem dem er helt elastiske stød. Derudover overholder de den ideelle gaslov.

Ved standardtryk og temperatur (STP): 1 atm tryk og en temperatur på 0 ºC opfører de fleste af de virkelige gasser kvalitativt som ideelle gasser; så længe dens densitet er lav. Store intermolekylære eller interatomære afstande (for ædelgasser) letter sådanne tilnærmelser..
Under STP-forhold opfører ilt, nitrogen, brint, ædelgasser og nogle gasser i sammensat form, såsom kuldioxid, sig som en ideel gas..
Den ideelle gasmodel har tendens til at svigte ved lave temperaturer, høje tryk og høje partikeltætheder; når intermolekylære interaktioner såvel som partikelstørrelse bliver vigtige.
Den ideelle gaslov er en sammensætning af tre gaslove: Boyle og Mariottes lov, Charles og Gay-Lussacs lov og Avogadros lov..
Artikelindeks
- 1 Formel og enheder
- 2 Hvad fastlægger den ideelle gaslov?
- 3 applikationer
- 3.1 Beregning af densitet og molmasse af en gas
- 3.2 Beregning af volumenet af en gas produceret i en kemisk reaktion
- 3.3 Beregning af det partielle tryk på gasser, der findes i en blanding
- 3.4 Mængde gasser opsamlet i vand
- 4 Eksempler på beregninger
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 4.3 Øvelse 3
- 4.4 Øvelse 4
- 5 Referencer
Formel og enheder

Gasloven udtrykkes matematisk med formlen:
PV = nRT
Hvor P er det tryk, der udøves af en gas. Det udtrykkes normalt med atmosfærenheden (atm), selvom den kan udtrykkes i andre enheder: mmHg, pascal, bar osv..
Volumen V optaget af en gas udtrykkes normalt i enheder af liter (L). Mens n er antallet af mol, R den universelle gaskonstant og T temperaturen udtrykt i Kelvin (K).
Det mest anvendte udtryk i gasser for R er 0,08206 L atm K-1Muldvarp-1. Selvom SI-enheden for gaskonstanten har en værdi på 8,3145 J mol-1K-1. Begge er gyldige, så længe der tages forsigtighed med enhederne i de andre variabler (P, T og V).
Den ideelle gaslov er en kombination af Boyle-Mariottes lov, Charles-Gay-Lussacs lov og Avogadros lov.
Boyle-Mariotte lov
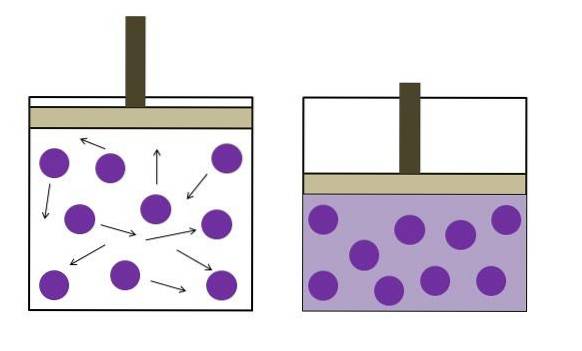
Det blev formuleret uafhængigt af fysikeren Robert Boyle (1662) og fysikeren og botanikeren Edme Mariotte (1676). Loven er angivet som følger: ved konstant temperatur er volumenet af en fast masse af en gas omvendt proportionalt med det tryk, den udøver.
PV ∝ k
Ved at bruge et kolon:
P1V1 = PtoVto
Charles-Gay-Lussac-loven

Loven blev offentliggjort af Gay-Lussac i 1803, men den henviste til det upubliserede arbejde af Jacques Charles (1787). Af denne grund er loven kendt som Charles's law..
Loven siger, at der ved konstant tryk er der et direkte proportionalt forhold mellem volumenet optaget af en gas og dens temperatur.
V ∝ ktoT
Ved at bruge et kolon:
V1/ T1 = Vto/ Tto
V1Tto = VtoT1
Avogadros lov
Loven blev forkyndt af Amadeo Avogadro i 1811 og påpegede, at lige store volumener af alle gasser ved samme tryk og temperatur har det samme antal molekyler.
V1/ n1 = Vto/ nto
Hvad siger den ideelle gaslov?
Den ideelle gaslov etablerer et forhold mellem fire uafhængige fysiske egenskaber af gas: tryk, volumen, temperatur og mængde af gassen. Det er nok at kende værdien af tre af dem for at være i stand til at opnå værdien af de resterende.
Loven fastlægger de betingelser, der indikerer, hvornår en gas opfører sig ideelt, og når den bevæger sig væk fra denne adfærd.
For eksempel har den såkaldte kompressionsfaktor (PV / nRT) en værdi på 1 for ideelle gasser. En afvigelse fra værdien 1 for kompressionsfaktoren indikerer, at gassens opførsel er langt fra den, der vises med en ideel gas.
Derfor vil der blive begået en fejl, når den ideelle gasligning anvendes på en gas, der ikke opfører sig i henhold til modellen.
Ansøgninger
Beregning af densitet og molmasse af en gas
Den ideelle gaslovligning kan bruges til at beregne densiteten af en gas og dens molære masse. Ved at foretage en simpel modifikation kan et matematisk udtryk findes, der relaterer densitet (d) af en gas og dens molære masse (M):
d = MP / RT
Og clearing M:
M = dRT / P
Beregning af volumenet af en gas produceret i en kemisk reaktion
Støkiometri er den gren af kemien, der relaterer mængden af hver af de tilstedeværende reaktanter med de produkter, der deltager i en kemisk reaktion, generelt udtrykt i mol..
Anvendelsen af den ideelle gasligning tillader bestemmelse af volumenet af en gas produceret i en kemisk reaktion; da antallet af mol kan opnås ved den kemiske reaktion. Derefter kan gasens volumen beregnes:
PV = nRT
V = nRT / P
Ved måling af V kan udbyttet eller forløbet af reaktionen bestemmes. Når der ikke er flere gasser, er det en indikation af, at reagenserne er helt opbrugt.
Beregning af partialtrykket af gasser, der er til stede i en blanding
Den ideelle gaslov kan bruges sammen med Daltons lov om delvis tryk til at beregne det delvise tryk for de forskellige gasser, der findes i en gasblanding..
Forholdet gælder:
P = nRT / V
For at finde trykket af hver af de gasser, der er til stede i blandingen.
Mængde gasser opsamlet i vand
En reaktion udføres, der producerer en gas, der opsamles ved hjælp af et eksperimentelt design i vand. Det samlede tryk på gassen plus vanddamptrykket er kendt. Værdien af sidstnævnte kan opnås i en tabel, og ved subtraktion kan gasens tryk beregnes.
Fra støkiometrien af den kemiske reaktion kan antallet af mol af gassen opnås og anvendelse af forholdet:
V = nRT / P
Volumen produceret gas beregnes.
Beregningseksempler
Øvelse 1
En gas har en densitet på 0,0847 g / L ved 17 ° C og et tryk på 760 torr. Hvad er dens molære masse? Hvad er gas?
Vi starter fra ligningen
M = dRT / P
Vi konverterer først enhederne til temperatur til kelvin:
T = 17 ºC + 273,15 K = 290,15 K
Og trykket på 760 torr svarer til trykket på 1 atm. Nu behøver du kun at erstatte værdierne og løse:
M = (0,0847 g / L) (0,08206 L atm K-1Muldvarp-1) (290,15 K) / 1 atm
M = 2,016 g / mol
Denne molære masse kan svare til en enkelt art: det diatomiske brintmolekyle, Hto.
Øvelse 2
En masse på 0,00553 g kviksølv (Hg) i gasfasen findes i et volumen på 520 L og ved en temperatur på 507 K. Beregn det tryk, der udøves af Hg. Molmassen af Hg er 200,59 g / mol.
Problemet løses ved hjælp af ligningen:
PV = nRT
Oplysninger om antallet af mol Hg vises ikke; men de kan opnås ved hjælp af deres molære masse:
Antal mol Hg = (0,00553 g Hg) (1 mol Hg / 200,59 g)
= 2.757 10-5 mol
Nu skal vi bare løse for P og erstatte værdierne:
P = nRT / V
= (2.757 10-5 mol) (8.20610-to L atm K-1Muldvarp-1) (507 K) / 520 L.
= 2,2 10-6 pengeautomat
Øvelse 3
Beregn det tryk, der genereres af saltsyren, der produceres ved at reagere 4,8 g chlorgas (Clto) med hydrogengas (Hto), i et volumen på 5,25 L og ved en temperatur på 310 K. Molmassen af Clto er 70,9 g / mol.
H2 g) + Cl2 g) → 2 HCI(g)
Problemet løses ved hjælp af den ideelle gasligning. Men mængden af HCI udtrykkes i gram og ikke i mol, så den korrekte transformation sker.
Mol HCI = (4,8 g Clto) (1 mol Clto/ 70,9 g Clto(2 mol HC1 / 1 mol Clto)
= 0,135 mol HC1
Anvendelse af den ideelle gaslovligning:
PV = nRT
P = nRT / V
= (0,135 mol HCI) (0,08206 L atm K-1Muldvarp-1) (310 K) / 5,25 l
= 0,65 atm
Øvelse 4
En prøve på 0,130 g af en gasformig forbindelse optager et volumen på 140 ml ved en temperatur på 70 ° C og et tryk på 720 torr. Hvad er dens molære masse?
For at anvende den ideelle gasligning skal der først foretages flere ændringer:
V = (140 ml) (1 L / 1000 ml)
= 0,14 L
Hvis vi tager volumen i liter, skal vi nu udtrykke temperaturen i kelvin:
T = 70 ºC + 273,15 K = 243,15 K
Og endelig skal vi konvertere trykket i atmosfærenheder:
P = (720 torr) (1 atm / 760 torr)
= 0,947 atm
Det første trin til løsning af problemet er at opnå antallet af mol af forbindelsen. Til dette bruges den ideelle gasligning, og vi løser det n:
PV = nRT
n = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 L atm K-1Muldvarp-1) (243,15 K)
= 0,067 mol
Du behøver kun at beregne den molære masse ved at dividere gramene med de opnåede mol:
Molær masse = gram forbindelse / antal mol.
= 0,130 g / 0,067 mol
= 19,49 g / mol
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Ira N. Levine. (2014). Principper for fysisk-kemi. Sjette udgave. Mc Graw Hill.
- Glasstone. (1970). Afhandling om fysisk kemi. Anden version. Aguilar.
- Mathews, C. K., Van Holde, K. E. og Ahern, K. G. (2002). Biokemi. 3det var Udgave. Udgiver Pearson Addison Wesley.
- Wikipedia. (2019). Ideel gas. Gendannet fra: en.wikipedia.org
- Redaktionelt hold. (2018). Boyles lov eller Boyle-Mariottes lov | Lov om gasser. Gendannet fra: iquimicas.com



Endnu ingen kommentarer