
Varmeabsorberede formler, hvordan man beregner det og løste øvelser
Det absorberet varme Det defineres som overførsel af energi mellem to kroppe ved forskellige temperaturer. Den med en lavere temperatur absorberer varmen fra den med en højere temperatur. Når dette sker, øges den termiske energi af det stof, der absorberer varme, og de partikler, der komponerer det, vibrerer hurtigere og hæver deres kinetiske energi..
Dette kan resultere i en temperaturforøgelse eller en tilstandsændring. Gå for eksempel fra fast til væske, såsom is, når det smelter i kontakt med vand eller sodavand ved stuetemperatur.

Takket være varmen er det også muligt for objekter at ændre deres dimensioner. Termisk ekspansion er et godt eksempel på dette fænomen. Når de fleste stoffer opvarmes, oplever de normalt en stigning i deres dimensioner.
En undtagelse herfra er vand. Den samme mængde flydende vand øger volumenet, når det køler ned under 4 ºC. Derudover kan temperaturændringer også opleve ændringer i dens densitet, noget der også er meget observerbart i tilfælde af vand..
Artikelindeks
- 1 Hvad det består af og formler
- 1.1 Kalorier
- 2 Sådan beregnes det?
- 2.1 Energibalancen
- 3 Øvelse løst
- 3.1 Fremgangsmåde
- 3.2 Data
- 4 Referencer
Hvad det består af og formler
I tilfælde af energi under transit er enhederne af absorberet varme Joule. Men i lang tid havde varmen sine egne enheder: kalorien.
Selv i dag bruges denne enhed til at kvantificere madindholdets energiindhold, selvom en diætkalorie svarer til en kilokalorie varme.
Kalorier
Kalorien, forkortet som Citron, er den mængde varme, der er nødvendig for at hæve temperaturen på 1 gram vand med 1 ºC.
I det 19. århundrede gennemførte Sir James Prescott Joule (1818 - 1889) et berømt eksperiment, hvor han formåede at omdanne mekanisk arbejde til varme og opnåede følgende ækvivalens:
1 kalorieindhold = 4,166 Joule
I britiske enheder kaldes varmeenheden Btu (Britisk termisk enhed), som defineres som den mængde varme, der er nødvendig for at hæve temperaturen på et pund vand med 1ºF.
Ækvivalensen mellem enheder er som følger:
1 Btu = 252 kalorier
Problemet med disse ældre enheder er, at mængden af varme afhænger af temperaturen. Det vil sige, at den, der kræves for at gå fra 70 ° C til 75 ° C, ikke er den samme som den, der kræves for at opvarme vandet fra f.eks. 9 ° C til 10 ° C..
Det er grunden til, at definitionen overvejer veldefinerede områder: fra 14,5 til 15,5 ° C og 63 til 64 ° F for henholdsvis kalorieindholdet og Btu..
Hvad afhænger mængden af absorberet varme af?
Mængden af absorberet varme, som et materiale opsamler, afhænger af flere faktorer:
- Masse. Jo større masse, jo mere varme er den i stand til at absorbere.
- Stoffets egenskaber. Der er stoffer, der afhængigt af deres molekylære eller atomare struktur er i stand til at absorbere mere varme end andre..
- Temperatur. Tilsætning af mere varme er nødvendig for at opnå en højere temperatur.
Mængden af varme, betegnet som Spørgsmål, den er proportional med de beskrevne faktorer. Derfor kan det skrives som:
Q = m.c.ΔT
Hvor m er genstandens masse, c er et konstant opkald specifik varme, en iboende egenskab af stoffet og ΔT er den temperaturvariation, der opnås ved at absorbere varme.
AT = TF - Teller
Denne forskel har et positivt tegn, da det forventes at absorbere varme TF > Teller. Dette sker, medmindre stoffet gennemgår en faseændring, såsom vand, der går fra væske til damp. Når vand koger, forbliver temperaturen konstant på ca. 100 ºC, uanset hvor hurtigt det koger..
Sådan beregnes det?
Ved at sætte to objekter i forskellige temperaturer i kontakt, når de efter et stykke tid begge når termisk ligevægt. Derefter udjævner temperaturerne, og varmeoverførslen ophører. Det samme sker, hvis mere end to genstande kommer i kontakt. Efter en vis tid vil de alle have samme temperatur.
Antages det, at genstandene i kontakt danner et lukket system, hvorfra varmen ikke kan undslippe, gælder princippet om energibesparelse, så det kan siges at:
Spørgsmål absorberet = - Q gav efter
Dette repræsenterer en energibalance svarende til en persons indkomst og udgifter. Af denne grund har den overførte varme et negativt tegn, da den endelige temperatur for den genstand, der giver, er lavere end den oprindelige. Derfor:
AT = TF - Teller < 0
Q-ligningen absorberet = - Q gav efter den bruges, når to genstande er i kontakt.
Energibalance
For at udføre energibalancen er det nødvendigt at skelne de objekter, der absorberer varme, fra de, der giver sig, og derefter:
Σ Qk= 0
Det vil sige, at summen af energiforøgelser og -tab i et lukket system skal være lig med 0.
Et stofs specifikke varme
For at beregne mængden af absorberet varme er det nødvendigt at kende den specifikke varme for hvert deltagende stof. Dette er den mængde varme, der kræves for at hæve temperaturen på 1 g materiale med 1ºC. Dens enheder i det internationale system er: Joule / kg. K.
Der er tabeller med den specifikke varme for mange stoffer, generelt beregnet ved hjælp af et kalorimeter eller lignende værktøjer..
Et eksempel på hvordan man beregner et materiales specifikke varme
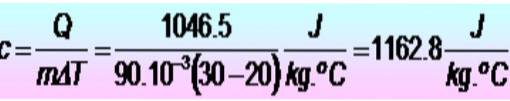
Der kræves 250 kalorier for at hæve temperaturen på en metalring fra 20 til 30 ºC. Hvis ringen har en masse på 90 g. Hvad er metalets specifikke varme i SI-enheder??
Opløsning
Enhederne konverteres først:
Q = 250 kalorier = 1046,5 J
m = 90 g = 90 x 10-3 kg
Træning løst
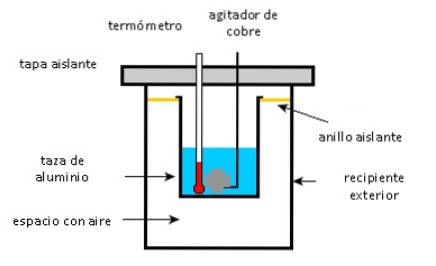
En aluminiumskop indeholder 225 g vand og en 40 g kobberomrører, alt sammen ved 27 ° C. En 400 g prøve sølv ved en indledende temperatur på 87 ° C anbringes i vandet.
Omrøreren bruges til at røre blandingen, indtil den når sin endelige ligevægtstemperatur på 32 ° C. Beregn massen af aluminiumskoppen, i betragtning af at der ikke er noget varmetab for miljøet.
Nærme sig
Som nævnt ovenfor er det vigtigt at skelne mellem objekter, der opgiver varme fra dem, der absorberer:
- Aluminiumskop, kobberomrører og vand absorberer varme.
- Sølvprøve giver varme.
Data
De specifikke varmer for hvert stof leveres:
- Sølv: c = 234 J / kg. ºC
- Kobber: c = 387 J / kg. ºC
- Aluminium c = 900 J / kg. ºC
- Vand c = 4186 J / kg. ºC
Varmen absorberet eller overført af hvert stof beregnes ved hjælp af ligningen:
Q = m.c.λT
Opløsning
Sølv
Spørgsmål gav efter = 400 x 10 -3 . 234 x (32 - 87) J = -5148 J
Kobberomrører
Spørgsmål absorberet = 40 x 10 -3 . 387 x (32 - 27) J = 77,4 J
Vand
Spørgsmål absorberet = 225 x 10 -3 . 4186 x (32 - 27) J = 4709,25 J
Aluminium krus
Spørgsmål absorberet = m aluminium . 900 x (32 - 27) J = 4500 .m aluminium
Brug af:
Σ Qk= 0
77,4 + 4709,25 + 4500 .m aluminium = - (-5148)
Endelig renses aluminiumens masse:
m aluminium = 0,0803 kg = 80,3 g
Referencer
- Giancoli, D. 2006. Fysik: Principper med applikationer. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fysik: Et blik på verden. 6ta Forkortet udgave. Cengage læring. 156 - 164.
- Rex, A. 2011. Grundlæggende fysik. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Universitetsfysik med moderne fysik. 14th. Volumen1. 556 - 553.
- Serway, R., Vulle, C. 2011. Fundamentals of Physics. 9na Cengage læring. 362 - 374



Endnu ingen kommentarer