
Sulfaminsyrestruktur, egenskaber, syntese, anvendelser

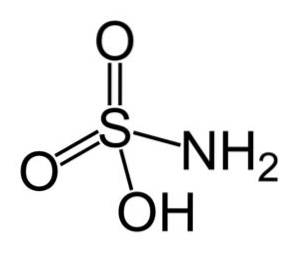
Det sulfaminsyre er en uorganisk forbindelse dannet af et svovlatom (S) kovalent bundet og ved enkeltbinding til en hydroxylgruppe (-OH) og til en aminogruppe (-NHtoog ved dobbeltbinding til to iltatomer (O). Det er et hvidt krystallinsk fast stof. Dens kemiske formel er NHtoSW3H. Også kendt som aminosulfonsyre, amidosulfonsyre, amidsvovlsyre og sulfamidinsyre..
Sulfaminsyre er en stærk syre. Det kan reagere med metaller, metaloxider og carbonater. Dens salte er normalt opløselige i vand, hvilket gør det til en god skalafjerner i procesudstyr. Det bruges ofte i sukkerfabrikker til at rense karbonatindskæringer i fordamperudstyr..
Sulfaminsyre er en nitritreduktionsmiddel (NOto-) og denne kemiske egenskab anvendes i forskellige anvendelser, såsom i farvestofindustrien og i nitritanalyse..
Det bruges i garvning af læder og blegning af papirmasse til papirfremstilling. Faktisk er det en fødevareforurening, da den ofte findes i papirer og pap, der bruges til at pakke dagligvarer..
Det bruges også til elektrodeposition af metaller, som en laboratoriestandard, og et af dets derivater er et meget effektivt herbicid..
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Tæthed
- 3.5 Opløselighed
- 3,6 pH
- 3.7 Dissociationskonstant
- 3.8 Kemiske egenskaber
- 3.9 Andre egenskaber
- 4 Syntese
- 5 anvendelser
- 5.1 I farvestofindustrien
- 5.2 I læderforarbejdning
- 5.3 I rengøringsprocesudstyr
- 5.4 I metalraffinering
- 5.5 Som standardreagens i laboratoriet
- 5.6 I nitritanalyse
- 5.7 I analysen af opløst ilt i vand
- 5.8 Ved fremstilling af dinitrogenoxid
- 5.9 I landbruget
- 5.10 På brandsikre stoffer
- 5.11 I forskellige applikationer
- 6 Referencer
Struktur
Sulfaminsyre krystalliserer i form af dipyramidale orthorhombiske krystaller. Danner kompakte prismer og plader ved krystallisering fra kold opløsning samt diamantplader ved krystallisering fra varm vandig opløsning.
Nomenklatur
- Sulfaminsyre
- Aminosulfonsyre
- Amidosulfonsyre
- Amidsvovlsyre
- Sulfamidinsyre
Ejendomme
Fysisk tilstand
Hvidt krystallinsk fast stof.
Molekylær vægt
97,1 g / mol.
Smeltepunkt
205 ºC, nedbrydes ved 209 ºC.
Massefylde
2,15 g / cm3
Opløselighed
Opløselig i vand:
- 12,8% ved 0 ºC
- 17,57% ved 20 ºC
- 22,77% ved 40 ºC
Let opløselig i methanol, let opløselig i acetone, uopløselig i ether.
Frit opløseligt i nitrogenholdige baser og i organiske opløsningsmidler, der indeholder nitrogen.
Uopløselig i carbondisulfid (CSto) og carbontetrachlorid (CCl4).
pH
0,41 (i 1 N opløsning, dvs. 1 ækvivalent / L).
Dissociation konstant
0,101 ved 25 ºC.
Kemiske egenskaber
Det er en stærk syre. Næsten lige så meget som saltsyre (HCl), salpetersyre (HNO3) og svovlsyre (HtoSW4).
Vandige opløsninger af sulfaminsyre er stærkt ioniserede. Dens pH er lavere end opløsningerne af myresyre, fosforsyre og oxalsyre.
I vand mister sulfaminsyre kun protonen, der er bundet til ilt. Hydrogener bundet til nitrogen holder tæt sammen.
I vandig opløsning hydrolyserer den langsomt for at give surt ammoniumsulfat (NH4HSO4). Den er stabil under tørre forhold.
Sulfaminsyre angriber metaller, metaloxider og carbonater for at danne sulfamater. For eksempel danner det med metalkalium (K) kaliumsulfamat (KOSO)toNHtoog hydrogen (Hto).
Alle salte af sulfaminsyre er opløselige i vand. Saltene af calcium, bly og barium er meget opløselige i vand i modsætning til de tilsvarende salte af svovlsyre.
Salpetersyre (HNOtoreagerer kvantitativt med aminogruppen sulfaminsyre og frigør nitrogen (Nto). Det estimeres, at sulfamationen fungerer i denne reaktion som et amid, ikke en amin..
Sulfaminsyre oxideres af klor, brom eller kaliumchlorat for at omdanne det til svovlsyre. Denne reaktion forekommer ikke med andre oxidanter såsom kromsyre eller kaliumpermanganat..
Det er ikke kompatibelt (reagerer) med stærke baser, klor, hypochlorsyre, hypochloritter, cyanider og sulfider.
Andre egenskaber
Det er ikke hygroskopisk (det betyder, at det ikke absorberer fugt fra luften).
Når det opvarmes til nedbrydning, udsender det meget giftige dampe af svovloxider og hydrogenchlorid (HCI).
Et af dets derivater, ammoniumsulfamat, er brandhæmmende.
Det er moderat giftigt.
Syntese
Sulfaminsyre opnås ved omsætning af urinstof CO (NHto)to med røgende svovlsyre, dvs. svovlsyre (HtoSW4) koncentrat indeholdende svovltrioxid (SO3).
Det kan også syntetiseres ved omsætning af chlorsulfonsyre (HClO)3Cl) og ammoniak (NH3).
Ansøgninger
I farvestofindustrien
Sulfaminsyre bruges til hurtigt og effektivt at fjerne overskydende nitrit i diazotiseringsreaktioner ved syntesen af farvestoffer. Det er meget mere praktisk end urinstof til dette formål.
I læderforarbejdning
Under lædergarvning giver brugen af sulfaminsyre i stedet for svovlsyre en finere og silkeagtig struktur.
Eftersom calciumsulfamat er opløseligt i vand, kan sulfaminsyre i modsætning til calciumsulfat desuden bruges i afgrænsningsprocessen uden at efterlade de pletter, der undertiden forekommer på læder, når man bruger svovlsyre..

I rengøringsprocesudstyr
Sulfaminsyre bruges som afkalkningsrenser i kedler, reaktorer, rør, kølesystemer og varmevekslere.
I dette udstyr dannes inkrustationer ved cirkulation af vand eller procesforbindelser i kraftværker, kemiske anlæg, stålværker, papirfabrikker, kompressionsstationer og andre industrier..
Skala eller faste aflejringer kan være organiske (alger, silt, svampe) eller uorganiske (jernoxider, jernsulfider, calcium- eller magnesiumcarbonater, sulfater, fosfater eller silicater).
Sulfaminsyre er meget effektiv, når den bruges til at fjerne calciumcarbonatskala. Kan bruges på kobber, messing, rustfrit stål, støbejern og galvaniseret ståludstyr.
Det anvendes i form af en 5-10 vægt-% opløsning. Det bruges især i sukkerfabrikker til at rense fordampere lavet af støbejern med kobbervarmevekslere.

Det skal bruges ved temperaturer, der ikke er højere end 50-60 ºC. Temperaturer på 70 ºC fører til dannelse af uopløselige sulfater såsom CaSO4.
Når det anvendes i kombination med natriumchlorid, opstår en synergistisk virkning, og opløsningen tillader jernoxid at opløses langsomt. I dette tilfælde bør den ikke bruges med rustfrit stål, fordi saltsyre frigøres, hvilket kan forårsage korrosion i dette materiale..
I metalraffinering
Elektroplettering af metaller såsom kobber, sølv, cobalt, nikkel, zink, cadmium, jern og bly kan med succes udføres i sulfaminsyreopløsninger. Dette kan håndteres meget lettere end hydrofluorkiselsyre (HtoSiF6).
Som standardreagens i laboratoriet
I betragtning af visse egenskaber ved sulfaminsyre, såsom: dens styrke som en syre, dens let at rense ved omkrystallisation i vand, dens stabilitet og dens ikke-hygroskopiske egenskaber, er den blevet brugt som en primær standard på laboratorieniveau. Dette betyder, at det bruges til kvantitative alkalibestemmelser..

I nitritanalyse
På grund af sin nemme reaktion med nitrit anvendes sulfaminsyre til at bestemme disse i opløsning..
I analysen af opløst ilt i vand
Da sulfaminsyre reagerer med nitritene i vandet, frigøres nitrogen, er det muligt at udføre bestemmelsen af opløst ilt i vand, da interferensen forårsaget af nitrit elimineres..
Ved fremstilling af dinitrogenoxid
Sulfaminsyre reagerer med salpetersyre og genererer nitrogenoxid (NtoELLER). Denne reaktion er sikrere end ammoniumnitrat for at opnå denne gas.
I landbruget
Et derivat af sulfaminsyre, ammoniumsulfamat, er et effektivt ikke-toksisk herbicid til dyr.
Den påføres med dug på artenes blade, der skal fjernes i slutningen af sommeren eller det tidlige efterår, helst i fugtigt vejr. Når forbindelsen bevæger sig fra bladene til rødderne, dør planten.

En anden fordel ved denne forbindelse er, at den ikke permanent steriliserer jorden. Faktisk vil noget af kvælstof fra ammoniumsulfamat være tilgængeligt i jorden til plantevækst i den næste sæson..
I brandsikre stoffer
Dens kompatibilitet med cellulose og dets brandhæmmende egenskaber gør ammoniumsulfamat til et middel til opnåelse af brandsikre stoffer og papir..
Det bruges til 10% af stoffets vægt, hvis udseende og følelse ved berøring forbliver uændret. Stoffet, når det er i brug, skal renses, aldrig vaskes med vand for ikke at opløse sulfamatet.
Det er især nyttigt i teatergardiner eller lignende steder.

I forskellige applikationer
Det bruges som katalysator i nogle kemiske reaktioner, såsom ved fremstilling af urinstof-formaldehydharpikser. Det er også nyttigt som baktericid og klorstabilisator i svømmebassiner og som blegemiddel til træmasse i papirmasse og papirfabrikker..
Referencer
- OS. National Library of Medicine. (2019). Sulfaminsyre. Gendannet fra pubchem.ncbi.nlm.nih.gov
- Williams, D.L.H. (2004) Nitrosering ved kvælstofcentre. I nitroseringsreaktioner og kemien af nitrogenoxid. Kapitel 2. Gendannet fra sciencedirect.com
- Clapp, Leallyn B. (1943). Sulfaminsyre og dens anvendelser. Chem. Educ. 1943, 20, 4, 189. Gendannet fra pubs.acs.org
- McDonald, James. (2003). Sulfaminsyre. Gendannet fra veoliawatertech.com
- Sastri, V.S. (2010). Styring og kontrol af korrosion. I Shreirs korrosion. Gendannet fra sciencedirect.com
- Pratima Bajpai. (2018). Diverse emner. I Biermanns håndbog om papirmasse og papir. Tredje udgave. Gendannet fra sciencedirect.com



Endnu ingen kommentarer