
Ændringer af tilstandstyper og deres egenskaber (med eksempler)

Det tilstandsændringer eller fase er et termodynamisk fænomen, hvor stof gennemgår reversible fysiske ændringer. Det siges at være termodynamisk, fordi der sker en overførsel af varme mellem stof og omgivelserne; eller hvad er det samme, der er interaktioner mellem stof og energi, der inducerer en omlejring af partiklerne.
Partiklerne, der gennemgår tilstandsændring, forbliver de samme før og efter ændringen. Tryk og temperatur er vigtige variabler i, hvordan de tilpasses i en eller anden fase. Når en tilstandsændring opstår, dannes et bifasisk system, der består af det samme stof i to forskellige fysiske tilstande.
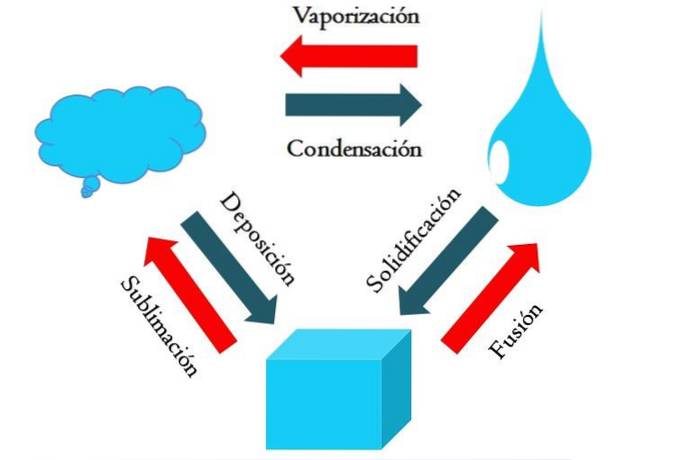
Billedet ovenfor viser de vigtigste tilstandsændringer, der betyder noget under normale forhold..
En solid terning af et blåligt stof kan blive flydende eller gasformigt afhængigt af temperaturen og trykket i omgivelserne. I sig selv repræsenterer det en enkelt fase: det faste stof. Men i øjeblikket af smeltning, dvs. smeltning, etableres en fast-flydende ligevægt kaldet fusion (rød pil mellem den blålig terning og dråbe).
For at fusion kan forekomme, skal terningen absorbere varme fra omgivelserne for at øge temperaturen; derfor er det en endoterm proces. Når kuben er helt smeltet, vender den tilbage til en enkelt fase: den i flydende tilstand.
Dette blålig dråbe kan fortsætte med at absorbere varme, hvilket øger temperaturen og resulterer i dannelsen af luftbobler. Igen er der to faser: den ene væske og den anden gas. Når al væsken er fordampet gennem kogepunktet, siges det at have kogt eller fordampet..
Nu blev de blålige dråber til skyer. Indtil videre har alle processer været endotermiske. Den blå gas kan fortsætte med at absorbere varme, indtil den bliver varm; I betragtning af de jordbundsforhold har det en tendens til at køle ned og kondensere tilbage i væsken (kondens)..
På den anden side kan skyer også aflejres direkte på en fast fase og igen danne den faste terning (aflejring). Disse sidste to processer er eksoterme (blå pile); de frigiver varme til miljøet eller omgivelserne.
Ud over kondens og aflejring opstår der en tilstandsændring, når den blålig dråbe fryser ved lave temperaturer (størkning).
Artikelindeks
- 1 Typer af tilstandsændringer og deres egenskaber
- 1.1 - Fusion
- 1.2 - Fordampning
- 1.3 - Kondens
- 1.4 - Størkning
- 1.5 - Sublimering
- 1.6 - Afsætning
- 2 Andre statusændringer
- 3 Referencer
Typer af tilstandsændringer og deres egenskaber
Billedet viser typiske ændringer for de tre (mest almindelige) tilstande af stof: fast stof, væske og gas. Ændringerne ledsaget af de røde pile er endotermiske og involverer absorption af varme; mens de ledsaget af de blå pile er eksoterme, frigiver de varme.
En kort beskrivelse af hver af disse ændringer vil blive lavet nedenfor og fremhæve nogle af deres karakteristika fra molekylær og termodynamisk ræsonnement..
- Fusion
Fusion er tilstandsændring af et stof fra fast til flydende..
I fast tilstand er partiklerne (ioner, molekyler, klynger osv.) "Fanger", placeret i faste positioner i rummet uden at være i stand til at bevæge sig frit. De er imidlertid i stand til at vibrere ved forskellige frekvenser, og hvis de er meget stærke, begynder den strenge orden, der pålægges af intermolekylære kræfter, at "falde fra hinanden"..
Som et resultat opnås to faser: en, hvor partiklerne forbliver begrænsede (faste), og en anden, hvor de er friere (flydende), nok til at øge de afstande, der adskiller dem. For at opnå dette skal det faste stof absorbere varme, og dermed vil dets partikler vibrere med større kraft..
Af denne grund er fusionen endoterm, og når den begynder siges det, at der opstår en ligevægt mellem faserne med fast-væske..
Varmen, der er nødvendig for at give anledning til denne ændring, kaldes varme eller molær fusionens entalpi (ΔHFus). Dette udtrykker den mængde varme (energi, hovedsageligt i enheder af kJ), som en mol stof i fast tilstand skal absorbere for at smelte og ikke blot hæve temperaturen.
Snebold

Med dette i tankerne forstås det, hvorfor en snebold smelter i hånden (øverste billede). Sne absorberer kropsvarme, hvilket er nok til at hæve sne temperaturen over 0 ° C.
Iskrystallerne i sneen absorberer lige nok varme til at smelte og til, at deres vandmolekyler får en mere rodet struktur. Mens sneen smelter, vil det dannede vand ikke øge temperaturen, da al varmen fra hånden bruges af sneen til at fuldføre sin smeltning.
- Fordampning

Fordampning er tilstandsændring af et stof fra flydende til gasform.
Fortsat med eksemplet med vand, hvor vi nu lægger en håndfuld sne i en gryde og tænder ilden, bemærkes det, at sneen hurtigt smelter. Når vandet opvarmes, begynder der at dannes små bobler af kuldioxid og andre mulige luftformige urenheder inde i det..

Varme udvider molekylært de uordnede konfigurationer af vand, udvider dets volumen og øger dets damptryk; derfor er der flere molekyler, der flygter fra overfladen som et resultat af stigende fordampning.
Flydende vand øger temperaturen langsomt på grund af dets høje specifikke varme (4.184J / ° C ∙ g). Der kommer et punkt, hvor den varme, den absorberer, ikke længere bruges til at hæve temperaturen, men til at starte væske-damp-ligevægten; det vil sige, det begynder at koge, og al væske vil gå til gasform, mens den absorberer varme og holder temperaturen konstant.
Det er her, du ser den intense boblende på overfladen af det kogte vand (øverste billede). Varmen absorberet af flydende vand, så damptrykket fra dets begyndende bobler er lig med det ydre tryk kaldes fordampningens entalpi (AhDamp).
Rollens rolle
Trykket er også afgørende i tilstandsændringerne. Hvad er dens virkning på fordampning? Jo højere tryk, desto større varme, som vandet skal absorbere for at koge, og derfor fordamper det over 100 ° C.
Dette skyldes, at stigningen i tryk gør det vanskeligt for vandmolekylerne at flygte fra væsken til den gasformige fase..
Trykkogere bruger denne kendsgerning til deres fordel for at opvarme mad i vand til en temperatur over dets kogepunkt..
På den anden side, da der er et vakuum eller et fald i tryk, har flydende vand brug for en lavere temperatur for at koge og gå ind i den gasformige fase. Når vandet koger med meget eller lidt tryk, skal det absorbere dets respektive fordampningsvarme for at fuldføre dets tilstandsændring..
- Kondensation
Kondensation er tilstandsændring af et stof fra gasform til flydende tilstand.

Vandet er fordampet. Hvad er det næste? Vanddamp kan stadig øge temperaturen og blive en farlig strøm, der kan forårsage alvorlige forbrændinger..
Lad os dog antage, at det køler af i stedet. Hvordan? Frigivelse af varme til miljøet og frigivelse af varme siges at være en exoterm proces, der finder sted.
Ved at frigive varme begynder de meget energiske gasformige vandmolekyler at bremse. Deres interaktioner bliver også mere effektive, når dampens temperatur falder. Vanddråber dannes først, kondenseret fra dampen, efterfulgt af større dråber, der ender med at blive tiltrukket af tyngdekraften.
For fuldt ud at kondensere en given mængde damp skal du frigive den samme energi, men med det modsatte tegn, ved ΔHDamp; det vil sige dens entalpi af kondensation AhCond. Således etableres den inverse damp-væske-ligevægt.
Fugtige vinduer

Kondens kan ses på selve husets vinduer. I et koldt klima kolliderer vanddampen inde i huset med vinduet, som på grund af dets materiale har en lavere temperatur end andre overflader..
Der er det lettere for dampmolekylerne at klumpes sammen, hvilket skaber et tyndt hvidligt lag, der let kan fjernes manuelt. Da disse molekyler frigiver varme (opvarmning af glas og luft), begynder de at danne flere talrige klynger, indtil de første dråber kan kondensere (øverste billede).
Når dråberne bliver meget store, glider de ned ad vinduet og efterlader et vandspor.
- Størkning
Størkning er ændringen af et stofs tilstand fra flydende tilstand til fast tilstand.

Størkning sker som et resultat af afkøling; med andre ord, vandet fryser. For at fryse, skal vand frigive den samme mængde varme, som is absorberer for at smelte. Igen kaldes denne varme entalpi for størkning eller frysning, ΔHCong (-AHFus).
Når vandmolekylerne afkøles, mister de energi, og deres intermolekylære interaktioner bliver stærkere og mere retningsbestemte. Som et resultat arrangeres de takket være deres hydrogenbindinger og danner såkaldte iskrystaller. Mekanismen, hvormed iskrystaller vokser, har indflydelse på deres udseende: gennemsigtig eller hvid.

Hvis iskrystaller vokser meget langsomt, tilstopper de ikke urenheder, såsom gasser, der opløses i vand ved lave temperaturer. Således undgår boblene og kan ikke interagere med lyset; og derfor har du en is så gennemsigtig som en ekstraordinær isstatue (øverste billede).
Den samme ting, der sker med is, det kan ske med ethvert andet stof, der størkner ved afkøling. Måske er dette den mest komplekse fysiske ændring i terrestriske forhold, da flere polymorfe kan opnås.
- Sublimering
Sublimering er tilstandsændring af et stof fra faststof til gasform.
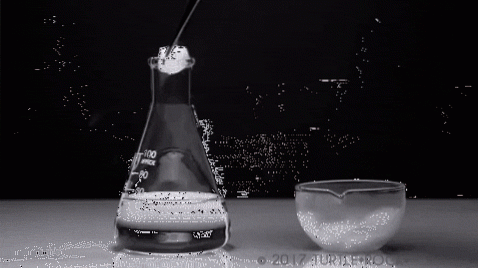
Kan vand sublimeres? Nej, i det mindste ikke under normale forhold (T = 25 ° C, P = 1 atm). For at sublimering kan forekomme, det vil sige ændring af tilstand fra fast til gas, skal dampens tryk på det faste være.
Ligeledes er det vigtigt, at deres intermolekylære kræfter ikke er meget stærke, helst hvis de kun består af dispersionskræfter.
Det mest symbolske eksempel er fast iod. Det er et krystallinsk fast stof med grå-lilla nuancer, der udviser et højt damptryk. Så meget, at der ved en handling afgives en lilla damp, hvis volumen og ekspansion bliver mærkbar, når de udsættes for opvarmning.

Et typisk eksperiment er vist på billedet ovenfor, hvor fast iod fordampes i en glasbeholder. Det er interessant og slående at observere, hvordan de lilla dampe diffunderer, og den initierede studerende kan verificere fraværet af flydende jod.
Dette er det vigtigste kendetegn ved sublimering: der er ingen tilstedeværelse af en flydende fase. Ligeledes er det endotermisk, da det faste stof absorberer varme for at øge dets damptryk, indtil det svarer til det ydre tryk..
- Afsætning

Deposition er tilstandsændring af et stof fra gasform til fast tilstand.
Parallelt med jodsublimeringseksperimentet er der afsætningen. Afsætning er den modsatte ændring eller overgang: stoffet går fra gasformig tilstand til faststof uden dannelse af en flydende fase.
Når lilla joddampe kommer i kontakt med en kold overflade, frigiver de varme for at varme den op, mister energi og omgrupperer deres molekyler tilbage i det grålig-lilla faste stof (øverste billede). Det er så en eksoterm proces.
Deponering anvendes i vid udstrækning til syntese af materialer, hvor de er dopet med metalatomer ved hjælp af sofistikerede teknikker. Hvis overfladen er meget kold, er varmeudvekslingen mellem den og damppartiklerne brat, idet passagen gennem den respektive væskefase udelades..
Aflejringens varme eller entalpi (og ikke depositum) er det inverse af sublimering (ΔHSub= - ΔHD.E.P.). I teorien kan mange stoffer sublimeres, men for at opnå dette er det nødvendigt at manipulere tryk og temperaturer ud over at have deres P vs T-diagram ved hånden; hvori dets fjerne mulige faser kan visualiseres.
Andre statusændringer
Selvom der ikke nævnes dem, er der andre sager. Nogle gange er de præget af at have "lidt af hver" og derfor være en kombination af dem. For at generere dem skal tryk og temperaturer manipuleres til meget positive (store) eller negative (små) størrelser..
Således, for eksempel, hvis gasser opvarmes for meget, mister de deres elektroner, og deres positivt ladede kerner i det negative tidevand udgør det, der kaldes plasma. Det er synonymt med "elektrisk gas", da den har en høj elektrisk ledningsevne.
På den anden side, når temperaturen falder for lavt, kan stof opføre sig på uventede måder; det vil sige, de udviser unikke egenskaber omkring absolut nul (0 K).
En af disse egenskaber er superfluiditet og superledningsevne; såvel som dannelsen af Bose-Einstein-kondensater, hvor alle atomer opfører sig som et.
Nogle undersøgelser peger endda på fotonisk stof. I dem grupperes partiklerne af elektromagnetisk stråling, fotoner, for at danne fotoniske molekyler. Det vil sige, det ville teoretisk være at give masse til lyslegemer.
Referencer
- Helmenstine, Anne Marie, Ph.D. (19. november 2018). Liste over faseændringer mellem stater af betydning. Gendannet fra: thoughtco.com
- Wikipedia. (2019). Sagen. Gendannet fra: en.wikipedia.org
- Dorling Kindersley. (2007). Ændrede stater. Gendannet fra: factmonster.com
- Meyers Ami. (2019). Faseændring: fordampning, kondens, frysning, smeltning, sublimering og deponering. Undersøgelse. Gendannet fra: study.com
- Bagley M. (11. april 2016). Matter: Definition & the Five States of Matter. Gendannet fra: livescience.com
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.



Endnu ingen kommentarer