
Valencia lag, hvad det består af, eksempler
Det valencia kappe Det er en, hvis elektroner er ansvarlige for de grundlæggende kemiske egenskaber. Elektronerne i denne skal interagerer med dem fra et nærliggende atom og danner således kovalente bindinger (A-B); og hvis de migrerer fra et atom til et andet mere elektronegative, ionbindinger (A + B-).
Dette lag er defineret af det primære kvantetal n, hvilket igen angiver den periode, hvor elementet er i det periodiske system. Mens gruppebestilling afhænger af antallet af elektroner, der kredser i valensskallen. Så for en n lig med 2, kan den optage otte elektroner: otte grupper (1-8).
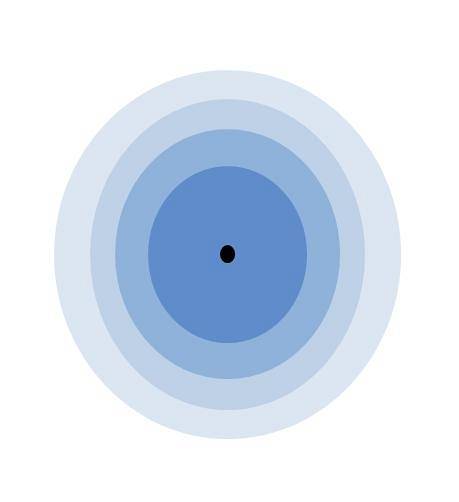
Billedet ovenfor illustrerer betydningen af valenslaget. Det sorte punkt i centrum af atomet er kernen, mens de resterende koncentriske cirkler er de elektroniske skaller defineret af n.
Hvor mange lag har dette atom? Hver af dem har sin egen farve, og da der er fire, så har atomet fire lag (n= 4). Bemærk også, at farven nedbrydes, når afstanden fra laget til kernen øges. Valenslaget er det, der er længst væk fra kernen: det med den lyseste farve.
Artikelindeks
- 1 Hvad er valenslaget?
- 2 funktioner
- 3 eksempler
- 3.1 Eksempel 1
- 3.2 Eksempel 2
- 4 Referencer
Hvad er valenslaget?
Ifølge billedet er valensskallen intet andet end de sidste orbitaler i et atom optaget af elektroner. I den lyseblå kappe, til n= 4, der er en serie af 4s, 4p, 4d og 4f orbitaler; dvs indeni er der andre underlag med forskellige elektroniske muligheder.
Et atom har brug for elektroner til at fylde alle de 4n orbitaler. Denne proces kan observeres i de elektroniske konfigurationer af elementerne over en periode.
For eksempel har kalium en [Ar] 4s elektronkonfiguration1, mens calcium, til højre, [Ar] 4sto. I henhold til disse indstillinger, hvad er valenslaget? Udtrykket [Ar] henviser til den elektroniske konfiguration af ædelgas argon 1sto2sto2 s63sto3p6. Dette repræsenterer det indre eller lukkede lag (også kendt som kerne).
Da 4s-orbitalen er den med den højeste energi, og hvori de nye elektroner kommer ind, repræsenterer den valensskallen for både K og Ca. Hvis K- og Ca-atomer blev sammenlignet med den i billedet, ville [Ar] være alle de indre lag farvet blå; og 4s det lyseblå lag, det ydre.
Egenskaber
Fra alt det ovennævnte kan nogle karakteristika ved valensskallen for alle atomer opsummeres:
-Dit energiniveau er højere; hvad der er det samme, fjernes det yderligere fra kernen og har den laveste elektrondensitet (sammenlignet med andre lag).
-Det er ufuldstændigt. Derfor vil det fortsætte med at fylde op med elektroner, når en periode krydses fra venstre mod højre i det periodiske system..
-Gribe ind i dannelsen af kovalente eller ioniske bindinger.
I tilfælde af metaller kalium og calcium oxideres de til at blive kationer. K+ den har en [Ar] elektronisk konfiguration på grund af at den mister sin eneste eksterne elektron 4s1. Og på siden af Cato+, dens konfiguration er også [Ar]; for i stedet for at miste en elektron mister du to (4sto).
Men hvad er forskellen mellem K+ og Cato+, hvis de begge mister elektronerne fra deres valensskal og har [Ar] elektronkonfiguration? Forskellen er i deres ioniske radier. ACto+ er mindre end K+, fordi calciumatomet har en ekstra proton, der tiltrækker eksterne elektroner med større kraft (lukkede eller valensskaller).
Valenslaget 4s er ikke forsvundet: det er kun tomt for disse ioner.
Eksempler
Begrebet valensskallen kan findes direkte eller indirekte i mange kemiske aspekter. Da dets elektroner er dem, der deltager i dannelsen af bindinger, bør ethvert emne, der adresserer dem (TEV, RPECV, reaktionsmekanismer osv.) Henvise til nævnte lag.
Dette er fordi vigtigere end valensskallen er dens elektroner; kaldes valenselektroner. Når de er repræsenteret i den progressive konstruktion af elektroniske konfigurationer, definerer disse atomens elektroniske struktur og derfor dets kemiske egenskaber..
Fra denne information om et atom A og et andet B kan strukturerne af deres forbindelser skitseres gennem Lewis-strukturer. Ligeledes kan de elektroniske og molekylære strukturer for en række forbindelser bestemmes takket være antallet af valenselektroner..
De enkleste og mulige eksempler på valenslag findes i det periodiske system; specifikt i elektronkonfigurationer.
Eksempel 1
Det er kun muligt at identificere et element og dets placering i det periodiske system med elektronkonfigurationen. Således, hvis et element X har konfiguration [Kr] 5sto5 s1, Hvad er det, og til hvilken periode og gruppe hører det til?
På grund af n= 5, X er i den femte periode. Derudover har den tre valenselektroner: to i 5'ers orbitalto og en i 5p1. Det indre lag [Kr] giver ikke flere oplysninger.
Da X har tre elektroner, og dens 5p orbitaler er ufuldstændige, er den i p-blokken; desuden i gruppe IIIA (romansk system) eller 13 (nuværende nummereringssystem og godkendt af IUPAC). X er så elementet indisk, In.
Eksempel 2
Hvad er elementet X med elektronkonfiguration [Kr] 4d105s1? Bemærk, at det ligesom i hører til periode 5, da 5'ers orbitale1 det er den med den højeste energi. Valensskallen inkluderer dog også de 4d orbitaler, da de er ufuldstændig.
Valenslagene kan derefter betegnes som nsnp for et element i p- eller s-blokken; eller (n-1) dns, for et element i blok d. Så det mystiske element X hører til blok d, fordi dets elektroniske konfiguration er af typen (n-1) dns (4d105s1).
Hvilken gruppe tilhører du? Tilføjelse af de ti elektroner i 4d orbital10, og en fra 5'ere1, X har elleve valenselektroner. Derfor skal den placeres i gruppe IB eller 11. Derefter snubler man over elementet sølv, Ag, når man bevæger sig gennem periode 5 i det periodiske system til gruppe 11..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (fjerde udgave, s. 23). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. Kemi. (8. udgave). CENGAGE Learning, s 287.
- NDT Resource Center. (s.f.). Valence Shell. Hentet fra: nde-ed.org
- Clackamas Community College. (2002). Valenselektroner. Gendannet fra: dl.clackamas.edu
- Kemi LibreTexts. (s.f.). Valens og kernelektroner. Gendannet fra: chem.libretexts.org


Endnu ingen kommentarer