
Kemisk struktur, egenskaber og anvendelser af siliciumcarbid

Det Siliciumcarbid Det er et kovalent fast stof, der består af kulstof og silicium. Det har stor hårdhed med en værdi på 9,0 til 10 på Mohs-skalaen, og dets kemiske formel er SiC, hvilket kan antyde, at kulstof er bundet til silicium ved en kovalent tredobbelt binding med en positiv ladning (+) på Si og en negativ ladning (-) på kulstof (+Ja≡C-).
Faktisk er obligationerne i denne forbindelse totalt forskellige. Det blev opdaget i 1824 af den svenske kemiker Jön Jacob Berzelius, mens han forsøgte at syntetisere diamanter. I 1893 opdagede den franske videnskabsmand Henry Moissani et mineral, hvis sammensætning indeholdt siliciumcarbid.

Denne opdagelse blev foretaget under undersøgelse af stenprøver fra krateret på en meteorit i Devil's Canyon, USA. Han kaldte dette mineral moissanit. På den anden side skabte Edward Goodrich Acheson (1894) en metode til at syntetisere siliciumcarbid, omsætte sand eller kvarts med høj renhed med petroleumskoks..
Goodrich navngav det opnåede produkt carborundum (eller carborundium) og grundlagde et firma til at producere slibemidler.
Artikelindeks
- 1 Kemisk struktur
- 2 egenskaber
- 2.1 Generelle egenskaber
- 2.2 Termiske egenskaber
- 2.3 Mekaniske egenskaber
- 2.4 Elektriske egenskaber
- 3 anvendelser
- 3.1 Som et slibende middel
- 3.2 I form af struktureret keramik
- 3.3 Andre anvendelser
- 4 Referencer
Kemisk struktur
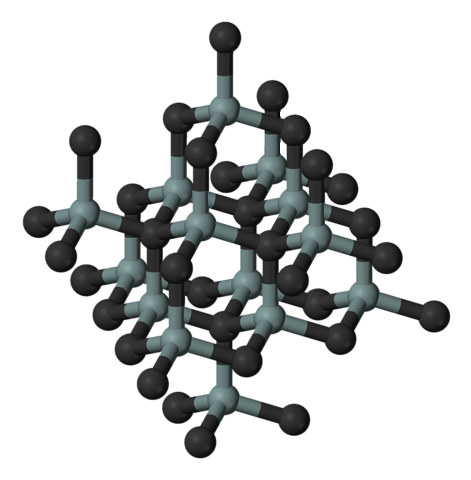
Billedet ovenfor illustrerer siliciumcarbids kubiske og krystallinske struktur. Dette arrangement er det samme som diamant på trods af forskellene i atomradier mellem C og Si..
Alle bindinger er stærkt kovalente og retningsbestemte, i modsætning til ioniske faste stoffer og deres elektrostatiske interaktioner.
SiC danner molekylær tetraeder; det vil sige, at alle atomer er bundet til fire andre. Disse tetraedriske enheder er sammenføjet af kovalente bindinger, der antager lagdelte krystallinske strukturer..
Disse lag har også deres egne krystalarrangementer, som er af tre typer: A, B og C.
Det vil sige, et lag A er forskelligt fra B, og det sidstnævnte fra C. Således består SiC-krystallen af stabling af en sekvens af lag, hvor fænomenet kendt som polytypisme forekommer..
For eksempel består den kubiske polytype (svarende til diamantens) af en stak ABC-lag og har derfor en 3C krystallinsk struktur..
Andre stakke af disse lag genererer også andre strukturer mellem disse rombohedrale og sekskantede polytyper. Faktisk ender de krystallinske strukturer af SiC med at være en "krystallinsk lidelse".
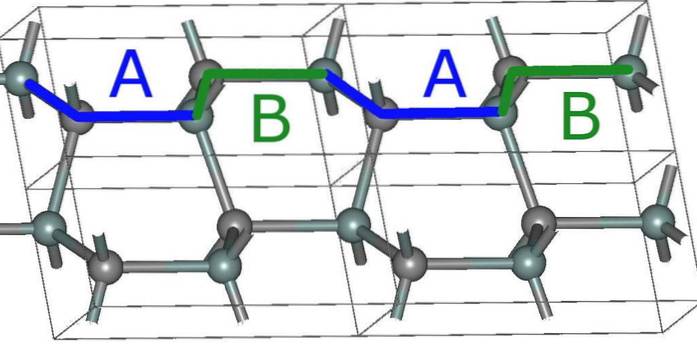
Den enkleste sekskantede struktur for SiC, 2H (øverste billede), dannes som et resultat af stablingen af lagene med ABABA-sekvensen ... Efter hvert andet lag gentages sekvensen, og det er her tallet 2 kommer fra.
Ejendomme
Generelle egenskaber
Molar masse
40,11 g / mol
Udseende
Det varierer med metoden til opnåelse og de anvendte materialer. Det kan være: gule, grønne, sortblå eller iriserende krystaller.
Massefylde
3,16 g / cm3
Smeltepunkt
2830 ºC.
Brydningsindeks
2,55.
Krystaller
Der er polymorfisme: αSiC sekskantede krystaller og βSiC kubiske krystaller.
Hårdhed
9 til 10 på Mohs-skalaen.
Modstandsdygtighed over for kemiske stoffer
Det er modstandsdygtigt over for virkningen af stærke syrer og baser. Derudover er siliciumcarbid kemisk inert..
Termiske egenskaber
- Høj varmeledningsevne.
- Tåler høje temperaturer.
- Høj varmeledningsevne.
- Lav koefficient for lineær termisk ekspansion, så den tåler høje temperaturer med lav ekspansion.
- Modstandsdygtig over for termisk stød.
Mekaniske egenskaber
- Høj kompressionsmodstand.
- Modstandsdygtig over for slid og korrosion.
- Det er et let materiale med stor styrke og modstand.
- Opretholder sin elastiske modstandsdygtighed ved høje temperaturer.
Ejendomme elektrisk
Det er en halvleder, der kan udføre sine funktioner ved høje temperaturer og ekstreme spændinger, med lidt spredning af sin strøm til det elektriske felt..
Ansøgninger
Som et slibende middel
- Siliciumcarbid er en halvleder, der er i stand til at modstå høje temperaturer, højspændingsgradienter eller elektrisk felt 8 gange mere end silicium kan tåle. Af denne grund er det nyttigt i konstruktionen af dioder, transitorer, suppressorer og højenergi mikrobølgeenheder..
- Lysemitterende dioder (LED'er) og detektorer til de første radioer (1907) blev lavet med forbindelsen. I øjeblikket er siliciumcarbid blevet erstattet ved fremstilling af LED-pærer med galliumnitrid, som udsender 10 til 100 gange lysere lys.
- I elektriske systemer bruges siliciumcarbid som en lynstang i elektriske elsystemer, da de kan regulere dets modstand ved at regulere spændingen over det..
I form af struktureret keramik
- I en proces kendt som sintring opvarmes siliciumcarbidpartiklerne - såvel som de af ledsagerne - til en temperatur, der er lavere end denne blandings smeltetemperatur. Således øger det modstanden og styrken af det keramiske objekt gennem dannelsen af stærke bindinger mellem partiklerne..
- Strukturkeramik af siliciumcarbid har haft en lang række anvendelser. De bruges i skivebremser og motorkøretøjskoblinger, i dieselpartikelfiltre og som et additiv i olier for at reducere friktion.
- Anvendelsen af siliciumcarbidkonstruktionskeramik er blevet udbredt i dele udsat for høje temperaturer. For eksempel er dette tilfældet med halsen på raketinjektorerne og ovnens ruller..
- Kombinationen af høj varmeledningsevne, sejhed og høj temperaturstabilitet gør komponenter til varmevekslerrør fremstillet af siliciumcarbid..
- Strukturel keramik anvendes i sandblæsningsinjektorer, vandpumpeforseglinger, lejer og ekstruderingsdyser til bilindustrien. Det er også materialet til smeltedigler, der anvendes i metalsmeltning..
- Det er en del af varmeelementerne, der anvendes til smeltning af glas og ikke-jernholdige metaller samt til varmebehandling af metaller.
Andre anvendelser
- Det kan bruges til måling af temperaturen på gasser. I en teknik kendt som pyrometri opvarmes en siliciumcarbidfilament og udsender stråling, der korrelerer med temperaturen i området 800-2500 ºK..
- Det bruges i atomkraftværker for at forhindre lækage af materiale produceret ved fission.
- Ved produktion af stål bruges det som brændstof.
Referencer
- Nicholas G. Wright, Alton B. Horsfall. Siliciumcarbid: Tilbagevenden til en gammel ven. Material Matters Volume 4 Article 2. Hentet den 5. maj 2018 fra: sigmaaldrich.com
- John Faithfull. (Februar 2010). Carborundum krystaller. Hentet den 5. maj 2018 fra: commons.wikimedia.org
- Charles & Colvard. Polytypisme og Moissanite. Hentet den 5. maj 2018 fra: moissaniteitalia.com
- Materialevidenskabsmand. (2014). SiC2H-struktur A. [Figur]. Hentet den 5. maj 2018 fra: commons.wikimedia.org
- Wikipedia. (2018). Siliciumcarbid. Hentet den 5. maj 2018 fra: en.wikipedia.org
- Navarro SiC. (2018). Siliciumcarbid. Hentet den 5. maj 2018 fra: navarrosic.com
- University of Barcelona. Siliciumcarbid, SiC. Hentet den 5. maj 2018 fra: ub.edu
- CarboSystem. (2018). Siliciumcarbid. Hentet den 5. maj 2018 fra: carbosystem.com



Endnu ingen kommentarer