
Cyanidinstruktur, hvor den findes, har fordele
Det cyanidin Det er en kemisk forbindelse, der tilhører gruppen af anthocyaniner. Disse bioaktive forbindelser har evnen til at reducere oxidativ skade såvel som antiinflammatoriske og antimutagene egenskaber, derfor er de af interesse i forskellige farmakologiske undersøgelser..
Derudover har anthocyaniner egenskaber ved naturlige vandopløselige farvestoffer. Disse er ansvarlige for den røde, blå og lilla pigmentering af planteprodukter, såsom frugt, blomster, stilke, blade osv..
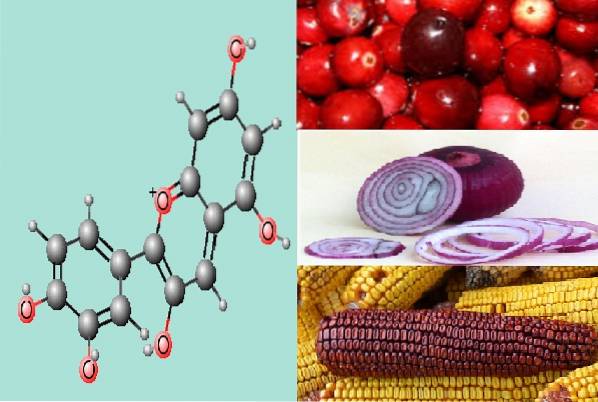
Cyanidin giver specifikt farve i frugterne af planter som mexicansk magenta majs, lilla pigmenteret rødkål og indfødte peruvianske kartofler, hvis pigmenter er henholdsvis røde og lilla..
I øjeblikket vurderes anthocyaniner bredt i fødevareindustrien til fordel for en mulig erstatning af syntetiske farvestoffer i fødevarer i kraft af at være harmløse stoffer. Det vil sige, de forårsager ikke skadelige eller skadelige virkninger på kroppen.
I denne forstand er inkorporering af antiocyaniner som madfarvestoffer allerede tilladt i nogle lande, forudsat at de specifikke overvejelser for deres anvendelse er opfyldt..
For eksempel er det i USA kun tilladt at bruge den del, der kan spises af planten, mens brugen i Mexico er etableret i specifikke fødevarer, såsom pølser, kosttilskud og visse ikke-alkoholiske drikkevarer..
Artikelindeks
- 1 Kemisk struktur
- 2 Hvor er den placeret?
- 3 Hvordan fungerer cyanidin til at bestemme pH?
- 4 Andre faktorer, der ændrer cyanidins egenskaber
- 5 Sundhedsmæssige fordele
- 6 Referencer
Kemisk struktur
Cyanidin er også kendt under navnet cyanidol, og dets molekylformel er: CfemtenHelleveELLER6.
Dens kemiske struktur, ligesom de andre anthocyaniner (pelargonidin, malvidin, petunidin, peonidin, delphinidin, blandt andre) er sammensat af en flavone kerne, defineret af nogle forfattere som ring C og to aromatiske ringe (A og B).
Tilstedeværelsen af disse tre ringe med dobbeltbindinger er det, der giver anthocyaniner deres pigmentering. Ligeledes skyldes definitionen af typen af anthocyanin mangfoldigheden af substituenter i positionen af carbon 3, 4 og 5 i ring B.
I strukturen af cyanidin er specifikt carbonerne i ring A og C nummereret fra 2 til 8, mens de fra ring B går fra 2 til 6. Derfor, når en hydroxylgruppe er placeret i ring B carbon 3 og i carbon 5 a hydrogen skelner denne ændring cyanidin fra resten af anthocyaninerne.
Hvor er det placeret?
Cyanidin er udbredt i naturen. Visse fødevarer såsom frugt, grøntsager og grøntsager har et højt indhold af denne forbindelse.
Dette bekræftes af nogle undersøgelser, hvor de har fundet en række cyanidinderivater, herunder cyanidin-3-glucosid, som det mest almindelige derivat, hovedsagelig indeholdt i kirsebær og hindbær..
Der henviser til, at cyanidin-3-soforosid, cyanidin 3-glucorutinosid, cyanidin 3-rutinosid, cyanidin-3-arabinosid, cyanidin-3-malonyl-glucosid og cyanidin-3-malonylarabinosid er mindre hyppige; skønt malonylderivater er til stede i større mængde i rødløg.
Ligeledes er der rapporteret om højt cyanidinindhold i jordbær, blåbær, druer, brombær, brombær, blommer, æbler og pitahaya (dragefrugt). Det skal bemærkes, at den højeste koncentration af cyanidin findes i frugtskaller.
Derudover er dets tilstedeværelse blevet verificeret i den mexicanske magenta korn majs, træ tomat, i frugten af den colombianske corozo (cyanidin-3-glucosid og cyanidin 3-rutinosid) og de pigmenterede native kartofler: blod af tyr (cyanidin 3-glucosid) og wenq'os, begge hjemmehørende i Peru.
Hvordan fungerer cyanidin til at bestemme pH?
I betragtning af dets egenskaber som farvestof og dets følsomhed over for pH-variationer anvendes cyanidin som en indikator i syre-basetitreringer. Dette ekstraheres almindeligvis fra rødkål eller kaldes også lilla kål (Brasica oleracea variant capitata f. rubra).

Under sure pH-betingelser, dvs. når pH falder (≤ 3), skifter kålblade farve og bliver røde. Dette skyldes overvejelsen af flavillium-kationen i cyanidinstrukturen..
Mens kålbladene ved neutral pH (7) opretholder deres blåviolette pigment, fordi der sker en deprotonering i cyanidinstrukturen og danner en blå quinoid base..
Tværtimod, hvis pH-betingelser er alkaliske, dvs. pH stiger fra 8 til 14, skifter kålbladens farve mod grønne, gule til farveløse toner ved ionisering af cyanidin og danner et molekyle kaldet chalcone.
Dette molekyle betragtes som slutproduktet af nedbrydning af cyanidin, og det kan derfor ikke regenerere til cyanidin igen..
Nylige undersøgelser antyder, at det anvendes i kemisk laboratoriepraksis som erstatning for konventionelle pH-indikatorer. Formålet ville være at reducere forurenende affald for miljøet.
Andre faktorer, der ændrer cyanidins egenskaber
Det skal bemærkes, at cyanidin mister sin farveegenskab ved opvarmning af opløsningen og bliver farveløs. Dette skyldes, at denne forbindelse er ustabil ved høje temperaturer..
Derudover er andre faktorer, såsom: lys, ilt, vandaktivitet, blandt andre, de største ulemper ved deres indarbejdelse i mad effektivt.
Af denne grund bør det tages i betragtning, at tilberedningsprocedurer i visse fødevarer favoriserer tabet af deres antioxidantkapacitet, som det er tilfældet med den oprindelige peruvianske wenq'os-kartoffel, der nedsætter cyanidinindholdet, når det stegtes..
Undersøgelser som Ballesteros og Díaz 2017 er imidlertid opmuntrende i denne henseende, da de har vist, at konservering i natriumbisulfit ved 1% w / v ved en temperatur på 4 ºC kan forbedre stabiliteten og holdbarheden af denne indikator, hvilket forlænger på denne måde dets brugstid.
Ligeledes er dets inkorporering i mejeriprodukter testet ved pH < 3 y almacenados a bajas temperaturas por corto tiempo, con el fin de conservar la estabilidad de la molécula y por ende sus propiedades.
Sundhedsmæssige fordele
I gruppen af anthocyaniner er cyanidin den mest relevante på grund af sin brede fordeling i en lang række frugter ud over det faktum, at dets forbrug har vist sig at være sikkert og effektivt til at hæmme reaktive iltarter og forhindre oxidativ skade i forskellige celler.
Derfor skiller cyanidin sig ud for sit ekstraordinære antioxidantpotentiale, hvilket gør det til et muligt biofarmaceutisk middel til forebyggelse af kræftcelleproliferation (tyktarmskræft og leukæmi), mutationer og tumorer..
Derudover tilskrives det antiinflammatoriske egenskaber. Endelig kan det reducere hjerte-kar-sygdomme, fedme og diabetes.
Referencer
- Salinas Y, García C, Coutiño B, Vidal V. Variabilitet i indhold og typer af anthocyaniner i blå / lilla korn fra mexicanske majspopulationer. phytotec. mex. 2013; 36 (Suppl): 285-294. Tilgængelig på: scielo.org.
- Castañeda-Sánchez A, Guerrero-Beltrán J. Pigmenter i røde frugter og grøntsager: Anthocyaniner. Udvalgte emner inden for Food Engineering 2015; 9: 25-33. Tilgængelig på: web.udlap.mx.
- Aguilera-Otíz M, Reza-Vargas M, Chew-Madinaveita R, Meza-Velázquez J. Funktionelle egenskaber af anthocyaniner. 2011; 13 (2), 16-22. Fås på: biotecnia.unison
- Torres A. Fysisk, kemisk og bioaktiv karakterisering af moden træ tomatpulp (Cyphomandra betacea(Cav.) Sendt. ALAN. 2012; 62 (4): 381-388. Tilgængelig på: scielo.org/
- Rojano B, Cristina I, Cortes B. Stabilitet af anthocyaniner og iltradikalabsorptionsevne (ORAC) værdier af vandige ekstrakter af corozo (Bactris guineensis). Rev Cubana Plant Med. 2012; 17 (3): 244-255. Fås på: sld.cu/scielo
- Barragan M, Aro J. Bestemmelse af effekten af madlavningsprocesser i pigmenterede native kartofler (Solanum tuberosum spp. andigena) på deres bioaktive forbindelser. undersøgt. Altoandin. 2017; 19 (1): 47-52. Fås på: scielo.org.
- Heredia-Avalos S. Overraskende kemiske oplevelser med hjemmelavede pH-indikatorer. Eureka Magazine om videnskabsundervisning og formidling. 2006; 3 (1): 89-103. Tilgængelig på: redalyc.org/
- Soto A, Castaño T. Undersøgelse af indkapslingen af anthocyaniner med sol-gel-teknikken til dets anvendelse som madfarve [kandidatafhandling] Autonomous University of Querétaro, Querétaro; 2018.Tilgængelig på: ri-ng.uaq.mx
- Ballesteros F, Díaz B, Herrera H, Moreno R. Anthocyanin som erstatning for syntetiske pH-indikatorer: et skridt mod grønne produkter [Miljøteknisk afhandling] Universidad de la Costa CUC, Barranquilla, Colombia; 2017.



Endnu ingen kommentarer