
Borsyre kemisk struktur, egenskaber, præparat, anvendelser
Det borsyre er en uorganisk forbindelse, hvis kemiske formel er H3BO3. Den består af et hvidt eller farveløst fast stof. Det er en svag syre, der i vandig opløsning, afhængigt af dens koncentration, producerer en pH mellem 3,8 og 4,8. Det er dårligt opløseligt i koldt vand og moderat opløseligt i varmt vand..
Borsyre blev opdaget i 1702 af Wilhelm Homberg (1652-1713), der behandlede borax med svovlsyre og opnåede en opløsning med medicinsk virkning, der fik navnet Hombergs beroligende vand..

Imidlertid påpeges det også, at Homberg forberedte borsyren ved at tilsætte vand til boraxen og opvarme opløsningen, indtil den fordampede, hvorved borsyrekrystallerne blev efterladt i sedimentet..
Denne syre er en meget nyttig forbindelse, der har adskillige anvendelser inden for industri og medicin, der også anvendes som et insekticid, træbeskyttelse, brandhæmmende og er en bestanddel af en pH-bufferopløsning..
Artikelindeks
- 1 Kemisk struktur
- 1.1 Krystaller
- 2 egenskaber
- 2.1 Navne
- 2.2 Molær masse
- 2.3 Fysisk udseende
- 2.4 Lugt
- 2.5 Smag
- 2.6 Smeltepunkt
- 2.7 Kogepunkt
- 2.8 Opløselighed i vand
- 2.9 Opløselighed i andre opløsningsmidler
- 2.10 Octanol / vand fordelingskoefficient
- 2.11 Surhed (pKa)
- 2,12 pH
- 2.13 Damptryk
- 2.14 Stabilitet
- 2.15 Nedbrydning
- 2.16 Reaktivitet
- 3 Forberedelse
- 4 anvendelser
- 4.1 I industrien
- 4.2 I medicin
- 4.3 Insekticid
- 4.4 Konservering
- 4,5 pH-buffer
- 4.6 Atomreaktorer
- 4.7 Landbrug
- 5 Kontraindikationer
- 6 Referencer
Kemisk struktur
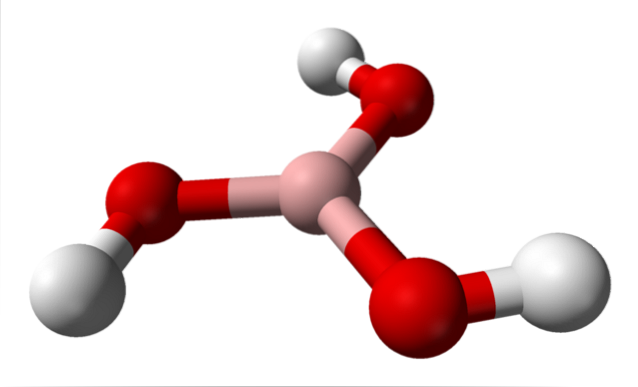
På det øverste billede har vi selve molekylet af H3BO3. Bemærk, at hydrogenatomer, repræsenteret af hvide kugler, ikke er bundet til det centrale boratom, som den kemiske formel antyder; men snarere til iltatomer repræsenteret af røde kugler.
En mere bekvem, skønt mindre anvendt formel for borsyre er således B (OH)3, hvilket indikerer, at dets surhed skyldes H-ioner+ frigivet fra deres OH-grupper. Molekylet B (OH)3 har en trigonal plangeometri, hvor dets boratom har en kemisk hybridisering spto.
B (OH)3 Det er et meget kovalent molekyle, da elektronegativitetsforskellen mellem boratomet og ilt ikke er særlig stor; så B-O-bindingerne er i det væsentlige kovalente. Bemærk også, at strukturen af dette molekyle ligner en spinner. Kan den rotere på sin egen akse på samme måde?
Krystaller
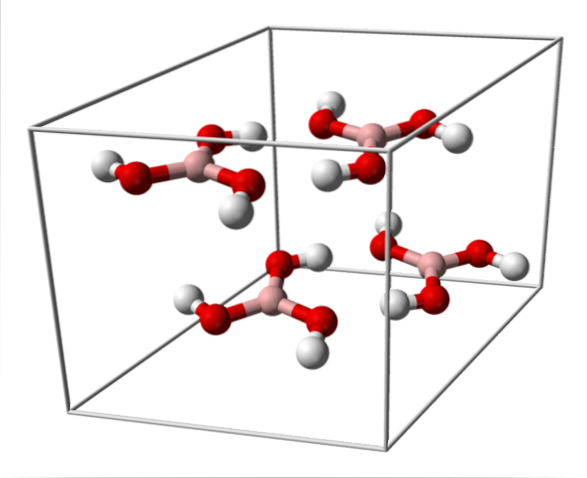
Det øverste billede viser enhedscellen, der svarer til den trikliniske krystalstruktur for borsyre, som under visse syntesebetingelser kan optage den kompakte sekskantede struktur. Bemærk, at der er fire molekyler pr. Celleenhed, og at de er arrangeret i to lag, A og B, skiftevis (de er ikke lagt oven på hinanden).
På grund af symmetrien og orienteringen af B-OH-bindingerne kan det antages, at B (OH)3 er apolar; men eksistensen af intermolekylære hydrogenbindinger ændrer historien. Hvert molekyle af B (OH)3 at give eller modtage tre af disse broer med i alt seks dipol-dipol-interaktioner som observeret i billedet nedenfor:
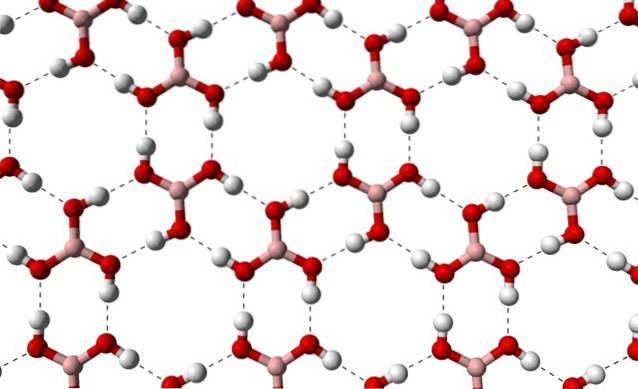
Bemærk, at disse hydrogenbindinger er de retningsbestemte interaktioner, der styrer borsyrekrystaller og etablerer mønstre af ornamentale aspekter; indre ringe måske med plads nok til at tilstoppe nogle urenheder, der ikke er i krystaldefekterne.
Disse hydrogenbindinger på trods af den lave molekylvægt af B (OH)3, de holder deres glas sammenhængende nok til at det har brug for en temperatur på 171 ºC for at smelte. Det vides ikke, hvilke virkninger høje tryk (i størrelsesordenen GPa) ville have på de molekylære lag af B (OH)3.
Ejendomme
Navne
IUPAC: borsyre og bortrihydrooxid. Andre navne: orthoborsyre, boracinsyre, sassolit, borofax og trihydroxyboran.
Molar masse
61,83 g / mol
Fysisk fremtoning
Klar, farveløs, krystallinsk hvidt fast stof. Det fås også som granulat eller som et hvidt pulver. Lidt cremet at røre ved.
Lugt
Toilet
Smag
Lidt bitter
Smeltepunkt
170,9 ºC
Kogepunkt
300 ºC
Vandopløselighed
Moderat opløselig i koldt vand og opløselig i varmt vand:
2,52 g / 100 ml (0 ºC)
27,50 g / 100 ml (100 ºC)
Borsyre er delvist opløselig i vand og har tendens til at synke ned i det. Denne opløselighed har tendens til at stige i nærvær af syrer, såsom saltsyre, citronsyre og vinsyre..
Opløselighed i andre opløsningsmidler
-Glycerol: 17,5% ved 25 ºC
-Ethylenglycol: 18,5% ved 25 ºC
-Aceton: 0,6% ved 25 ºC
-Ethylacetat: 1,5% ved 25 ºC
-Methanol: 172 g / L ved 25 ºC
-Ethanol: 94,4 g / L ved 25 ºC
Fordelingskoefficient for oktanol / vand
Log P = -0,29
Surhed (pKa)
9.24. 12.4. 13.3. Dette er de tre konstanter i deres respektive dissociationer for at frigive H+ i vand.
pH
3,8 - 4,8 (3,3% i vandig opløsning)
5,1 (0,1 molær)
Damptryk
1.6 10-6 mmHg
Stabilitet
Stabil i vand
Nedbrydning
Det nedbrydes ved opvarmning over 100 ° C og danner borsyreanhydrid og vand.
Reaktivitet
Borsyre danner opløselige salte med monovalente kationer, for eksempel: NatoB4ELLER7.10HtoO og uopløselige salte med divalente kationer, CaB4ELLER7.6HtoELLER.
I vandig opløsning producerer den en sur opløsning og tænker, at denne egenskab skyldtes subtraktion af OH-grupper- af vandet. Borsyre er klassificeret som en svag syre af Lewis-typen.
Borsyre reagerer med glycerol og mannitol, hvilket øger surheden i det vandige medium. PKa er modificeret fra 9,2 til 5 på grund af dannelsen af bor-mannitolchelat [BC6H8ELLERto(OH)to]-, der frigiver H+.
Forberedelse
Borsyre findes i en fri tilstand i vulkanske udstråling i regioner som Toscana i Italien, Lipari-øerne og i staten Nevada, USA. Det findes også i mineraler som borax, boracit, ulexit og colemanite..
Borsyre fremstilles hovedsageligt ved omsætning af mineralet borax (natriumtetraborat-decahydrat) med mineralsyrer, såsom saltsyre, svovlsyre osv..
NatoB4ELLER910HtoO + HCI => 4 H3BO3 + 2 NaCl + 5HtoELLER
Det fremstilles også ved hydrolyse af bortrihalogenid og diboran..
Borsyre fremstilles af colemanit (CatoB6ELLERelleve6 HtoELLER). Fremgangsmåden består i behandling af mineralet med svovlsyre for at opløse borforbindelserne.
Derefter separeres opløsningen, hvor borsyre er til stede, fra de uopløste fragmenter. Opløsningen behandles med hydrogensulfid for at præcipitere urenhederne i arsen og jern. Supernatanten afkøles til dannelse af et borsyreudfældning og adskilles fra suspensionen..
Ansøgninger
I branchen
Borsyre anvendes til fremstilling af glasfiber. Ved at hjælpe med at reducere smeltepunktet øger det styrken og effektiviteten af tekstilfiberglas: et materiale, der bruges til at forstærke plastik, der bruges i skibe, industrielle rør og computerkredsløb..
Borsyre deltager i fremstillingen af borosilikatglas, hvilket gør det muligt at opnå et glas, der er modstandsdygtigt over for temperaturændringer, der kan bruges i hjemmets køkken, i glasvarer i laboratorier, lysstofrør, fiberoptik, LCD-skærme osv..
Det bruges i den metallurgiske industri til at hærde og behandle stållegeringer samt til at fremme metallisk belægning af materialer.
Det bruges som en kemisk komponent i hydraulisk frakturering (fracking): en metode, der anvendes til olie- og gasekstraktion. Borsyre fungerer som et brandhæmmende middel i cellulose, plast og tekstilmaterialer, der er imprægneret med borsyre for at øge deres modstandsdygtighed over for ild..
I medicin
Borsyre bruges fortyndet i øjenskyl. Borsyre gelatinekapsler anvendes til behandling af svampeinfektioner, især Candida albicans. Det er også blevet brugt til behandling af acne.
Borsyre drysses på sokker for at forhindre fodinfektioner, såsom atletfod. Ligeledes anvendes opløsninger indeholdende borsyre til behandling af ekstern otitis hos mennesker såvel som hos dyr..
Borsyre tilsættes til flaskerne, der bruges til urinopsamling, hvilket forhindrer bakteriel kontaminering, inden de undersøges i diagnostiske laboratorier..
Insekticid
Borsyre bruges til at kontrollere spredning af insekter, såsom kakerlakker, termitter, myrer osv. Det dræber ikke øjeblikkeligt kakerlakker, da det først påvirker deres fordøjelses- og nervesystem, ud over at ødelægge deres eksoskelet.
Borsyre udøver sin handling langsomt, så insekter, der har indtaget den, kommer i kontakt med andre insekter og spreder dermed forgiftning..
Bevarelse
Borsyre bruges til at forhindre angreb af træ af svampe og insekter, der anvendes til dette formål sammen med ethylenglycol. Denne behandling er også effektiv til bekæmpelse af silt og alger..
PH-buffer
Borsyre og dens konjugatbase danner et puffersystem med pKa = 9,24, hvilket indikerer, at denne puffer er mest effektiv ved alkalisk pH, hvilket ikke er almindeligt hos levende væsener. Boratbuffer anvendes imidlertid til regulering af pH i svømmehaller..
Atomreaktorer
Borsyre har evnen til at fange termiske neutroner, hvilket reducerer muligheden for ukontrolleret nuklear fission, der kan føre til nukleare ulykker..
landbrug
Bor er et vigtigt element for plantevækst, hvilket førte til brugen af borsyre til elementets bidrag. Imidlertid kan for meget borsyre skade planter, især citrusfrugter..
Kontraindikationer
Brug af borsyre på denuderet hud, sår eller forbrændingsprodukt, der tillader dets absorption, bør undgås. Dette er en giftig forbindelse inde i kroppen, og i nogle tilfælde kan det forårsage besvimelse, kramper, kramper, ansigts-tics og lavt blodtryk..
Lægen bør konsulteres om brugen af borsyre vaginale kapsler hos gravide kvinder, da det er blevet indikeret, at det kan forårsage fosterdeformationer og et fald i barnets kropsvægt ved fødslen..
Placering af borsyre, der anvendes som insekticid, steder, der er inden for børns rækkevidde, bør også undgås, da børn har en større følsomhed over for den toksiske virkning af borsyre og fastlægger den dødelige dosis i dem til 2.000 til 3.000 mg..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Borsyre. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Borsyre. PubChem-database. CID = 7628. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Redaktørerne af Encyclopaedia Britannica. (28. marts 2019). Borsyre. Encyclopædia Britannica. Gendannet fra: britannica.com
- Transportør Vibrerende. (9. november 2018). De skjulte anvendelser af borsyre i dit daglige liv. Gendannet fra: carriervibrating.com
- Nationalt informationscenter for pesticider. (s.f.). Borsyre. Gendannet fra: npic.orst.edu
- Udarbejdelse. (30. november 2017). Borsyre: egenskaber og anvendelser af denne kemiske forbindelse. Gendannet fra: acidos.info
- Chloridnatrium. (2019). Borsyre. Gendannet fra: chlorurosodio.com
- Spanish Society of Hospital Pharmacy. (s.f.). Borsyre. [PDF]. Gendannet fra: workgroups.sefh.es
Endnu ingen kommentarer