
Transamineringsmekanisme, funktion og eksempler
Det transaminering er en type kemisk reaktion, der fungerer ved "omfordeling" af aminogrupper mellem aminosyrer, da det involverer reversible amineringsprocesser (tilsætning af en aminogruppe) og deaminering (eliminering af en aminogruppe), som katalyseres af specifikke enzymer, som transaminaser eller aminotransferaser.
Den generelle transamineringsreaktion involverer udvekslingen mellem en aminosyre og en hvilken som helst a-ketosyre, hvor udvekslingen af en aminogruppe giver ketoacid-versionen af det første substrataminosyre og aminosyreversionen af det første substrat a-ketoacid..

Den aminogruppe, der sædvanligvis udveksles, er "alfa" -aminoen, det vil sige den, der deltager i dannelsen af peptidbindinger, og som definerer strukturen af aminosyrer, skønt reaktioner, der involverer andre aminogrupper, der er til stede i forskellige positioner, også kan forekomme..
Med undtagelse af lysin, threonin, prolin og hydroxyprolin deltager alle aminosyrer i transamineringsreaktioner, selvom transaminaser er blevet beskrevet for histidin, serin, methionin og phenylalanin, men deres metaboliske veje involverer ikke denne type reaktioner..
Transamineringsreaktionerne mellem aminosyrer og α-ketosyrer blev opdaget i 1937 af Braunstein og Kritzmann, og siden da har de været genstand for intensive undersøgelser, da de forekommer i mange væv fra forskellige organismer og med forskellige formål..
Hos mennesker er transaminaser for eksempel bredt fordelt i kropsvæv og er især aktive i hjertemuskelvæv, lever, skeletmuskelvæv og nyrer..
Artikelindeks
- 1 Reaktionsmekanisme
- 2 Transamineringens funktion
- 3 eksempler
- 4 Referencer
Reaktionsmekanisme
Transamineringsreaktioner involverer mere eller mindre den samme mekanisme. Som diskuteret ovenfor forekommer disse reaktioner som en reversibel udveksling af en aminogruppe mellem en aminosyre og en a-ketosyre (deamineret), hvilket producerer a-ketosyren i donoraminosyren og aminosyren i a-ketosyren receptor..
Disse reaktioner afhænger af en forbindelse kendt som pyridoxalphosphat, et derivat af vitamin B6, der deltager som en transportør af aminogrupper, og som binder til transaminaseenzymer gennem dannelsen af en Schiff-base mellem aldehydgruppen i dette molekyle. Og ε-amino af en lysinrest i enzymets aktive sted.
Bindingen mellem pyridoxalphosphat og lysinresten i det aktive sted er ikke kovalent, men forekommer gennem den elektrostatiske interaktion mellem den positive ladning af nitrogen på lysin og den negative ladning på phosphatgruppen af pyridoxal.
I løbet af reaktionen fortrænger aminosyren, der fungerer som et substrat, e-aminogruppen i lysinresten i det aktive sted, der deltager i Schiff's base med pyridoxal.
I mellemtiden fjernes et par elektroner fra aminosyrens alfa-carbon og overføres til pyridinringen, der udgør pyridoxalphosphat (positivt ladet) og derefter "leveres" til α-ketosyren, der fungerer som et andet substrat..
På denne måde deltager pyridoxalphosphat ikke kun i overførslen eller transporten af aminogrupper mellem aminosyrer og α-keto-syrer, der er substrater for transaminaser, men fungerer også som en "synke" af elektroner, hvilket letter dissociationen af alfa-aminosyrehydrogenet..
Sammenfattende overfører det første substrat, en aminosyre, sin aminogruppe til pyridoxalphosphat, hvorfra det efterfølgende overføres til det andet substrat, en a-ketosyre, der i mellemtiden danner en mellemforbindelse kendt som pyridoxaminphosphat..
Transamineringens funktion
Transaminaseenzymer findes generelt i cytosol og mitokondrier og fungerer i integrationen af forskellige metaboliske veje.
Glutamatdehydrogenase i sin omvendte reaktion kan for eksempel omdanne glutamat til ammonium, NADH (eller NADPH) og α-ketoglutarat, som kan komme ind i tricarboxylsyrecyklussen og fungere i energiproduktion.
Dette enzym, der er i den mitokondrie matrix, repræsenterer et forgreningspunkt, der forbinder aminosyrer med energimetabolisme, så når en celle mangler nok energi i form af kulhydrater eller fedtstoffer til at fungere, kan den alternativt bruge nogle aminosyrer til det samme formål.
Dannelsen af enzymet (glutamatdehydrogenase) under hjernens udvikling er afgørende for bekæmpelsen af ammoniumafgiftning, da det har vist sig, at nogle tilfælde af mental retardation har at gøre med en lav aktivitet heraf, hvilket fører til ammoniumopbygning, hvilket er skadelig for hjernens sundhed.
I nogle leverceller kan transamineringsreaktioner også anvendes til syntese af glucose ved glukoneogenese.
Glutamin omdannes til glutamat og ammonium af enzymet glutaminase. Glutamat omdannes derefter til α-ketoglutarat, der går ind i Krebs-cyklussen og derefter glukoneogenese. Dette sidste trin opstår takket være det faktum, at malat, et af ruteens produkter, transporteres ud af mitokondrierne ved hjælp af en shuttle..
Denne shuttle efterlader α-ketoglutarat efter det malic enzym, der omdanner det til pyruvat. To pyruvatmolekyler kan derefter omdannes til et glukosemolekyle gennem gluconeogenese..
Eksempler
De mest almindelige transamineringsreaktioner er relateret til aminosyrerne alanin, glutaminsyre og asparaginsyre..
Nogle aminotransferaseenzymer kan ud over pyridoxalphosphat bruge pyruvat som et "coenzym", såsom glutamat-pyruvat-transaminase, som katalyserer følgende reaktion:
glutamat + pyruvat ↔ alanin + α-ketoglutarat
Muskelceller er afhængige af denne reaktion for at producere alanin fra pyruvat og for energi gennem Krebs-cyklussen via α-ketoglutarat. I disse celler afhænger brugen af alanin som energikilde af eliminering af aminogrupper såsom ammoniumioner i leveren gennem urinstofcyklussen..
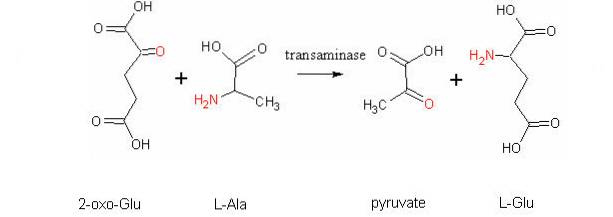
En anden meget vigtig transamineringsreaktion i forskellige arter er den, der katalyseres af enzymet aspartataminotransferase:
L-aspartat + α-ketoglutarat ↔ Oxaloacetat + L-glutamat
Sidst men ikke mindst, transamineringsreaktionen af γ-aminosmørsyre (GABA), en ikke-proteinaminosyre, der er essentiel for centralnervesystemet, der fungerer som en hæmmende neurotransmitter. Reaktionen katalyseres af en y-aminosmørsyre-transaminase og er omtrent som følger:
α-ketoglutarat + 4-aminobutansyre ↔ Glutamat + ravsyre semialdehyd
Succinic semialdehyd omdannes til succinic acid gennem en oxidationsreaktion, og sidstnævnte kan komme ind i Krebs-cyklussen til energiproduktion.
Referencer
- Bhagavan, N. V., & Ha, C. E. (2002). Protein og aminosyre metabolisme. Medicinsk biokemi (4. udgave), Academic Press: San Diego, CA, USA, 331.
- Cammarata, P. S. og Cohen, P. P. (1950). Omfanget af transamineringsreaktionen i dyrevæv. Journal of Biological Chemistry, 187, 439-452.
- Ha, C. E., & Bhagavan, N. V. (2011). Essentials of medical biochemistry: med kliniske tilfælde. Akademisk presse.
- Litwack, G. (2017). Human biokemi. Akademisk presse.
- Rowsell, E. V. (1956). Transamineringer med pyruvat og andre α-ketosyrer. Biochemical Journal, 64 (2), 246.
- Snell, E. E., & Jenkins, W. T. (1959). Transamineringsreaktionens mekanisme. Journal of cellulær og komparativ fysiologi, 54 (S1), 161-177.



Endnu ingen kommentarer