
Bromsyre (HBrO3) egenskaber, risici og anvendelser
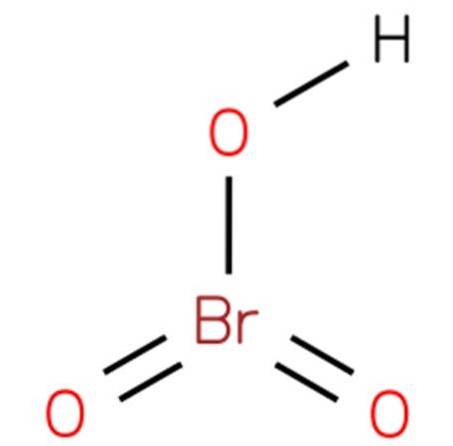
Det bromsyre, Også kendt som hydrogenbromat eller bromsyre (V), det er en kemisk forbindelse med formlen HBrO3. Det er en bromoxacid med en struktur, der er analog med klorsyre (EMBL-EBI, 2014). Forbindelsen er en meget stærk syre. Dens struktur er vist i figur 1 (EMBL-EBI, 2008).
Til fremstilling af bromsyre opløses et opløseligt bromat normalt i vand, og der tilsættes et opløseligt bariumsalt. Lavopløseligt bariumbromat udfældes.
Bariumbromaten kan derefter opløses i vand og syrnes med svovlsyre for at udfælde det grundlæggende uopløselige bariumsulfat og efterlade bromsyren (se billedet ovenfor):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Forbindelsen kan også fremstilles ved nedbrydning af brompentachlorid i alkalisk opløsning ifølge reaktionen:
BrCl5 + 3 H2O → HBrO3 + 5 HCI
Bromsyre er et stærkt oxidationsmiddel. Bromationen kan yderligere oxideres med elementært fluor eller xenondifluorid i nærværelse af base, oxidation ledsaget af små eksplosioner og Teflon-røret fanget i ild (My Favorite Chemicals, S.F.).
Artikelindeks
- 1 Bromsyre fysiske og kemiske egenskaber
- 2 Reaktivitet og farer
- 2.1 I tilfælde af kontakt med øjnene
- 2.2 I tilfælde af hudkontakt
- 2.3 I tilfælde af indånding
- 3 anvendelser
- 4 Referencer
Bromsyres fysiske og kemiske egenskaber
Bromsyre findes kun i farveløs opløsning (op til 50% w / v), der bliver gullig i kontakt med luft (National Center for Biotechnology Information., 2017). Dens udseende er vist i figur 2.

Forbindelsen har en molekylvægt på 128,91 g / mol og nedbrydes ved 100 ° C og har en pKa på -2. At være en ustabil forbindelse blev dens fysisk-kemiske egenskaber opnået gennem beregningsberegninger..
Det har et smeltepunkt på 206,04 ° C, et kogepunkt på 517,26 ° C og en opløselighed i vand på 1 x 106 mg / l ved 25 ° C (Royal Society of Chemistry, 2015).
Forbindelsen er et stærkt oxidationsmiddel. Når det blandes med ethanol eller ether, nedbrydes det til dannelse af eddikesyre i en eksoterm reaktion. Det er vigtigt for udarbejdelsen af bromatsalte (BrO3-), der fremstilles ved omsætning af carbonater eller metaloxider med bromsyre (Watts, 1870).
Reaktivitet og farer
Bromsyre er en ustabil forbindelse, der nedbrydes til elementært brom. At være en stærk syre er det yderst farligt i tilfælde af kontakt med huden (ætsende og irriterende), i kontakt med øjnene (irriterende) og i tilfælde af indtagelse. Meget farligt også i tilfælde af indånding.
Alvorlig overeksponering kan forårsage lungeskader, kvælning, bevidsthedstab eller død. Langvarig eksponering kan forårsage forbrændinger og sår på huden. Overeksponering ved indånding kan forårsage irritation af luftvejene..
Betændelse i øjet er kendetegnet ved rødme, vanding og kløe. Betændelse i huden er kendetegnet ved kløe, afskalning, rødme og lejlighedsvis blærer.
Stoffet er giftigt for nyrer, lunger og slimhinder. Gentagen eller langvarig eksponering for stoffet kan forårsage skader på disse organer..
I tilfælde af kontakt med øjnene
Kontroller, om der er kontaktlinser, og fjern dem straks. Øjnene skal skylles med rindende vand i mindst 15 minutter, idet øjenlågene holdes åbne. Koldt vand kan bruges. Øjen salve bør ikke bruges.
I tilfælde af hudkontakt
Hvis kemikaliet kommer i kontakt med tøj, skal du fjerne det så hurtigt som muligt og beskytte dine egne hænder og krop. Anbring offeret under et sikkerhedsbrusebad.
Hvis kemikaliet akkumuleres på offerets udsatte hud, såsom hænder, vaskes den forurenede hud forsigtigt og omhyggeligt med rindende vand og ikke-slibende sæbe. Koldt vand kan bruges. Søg lægehjælp, hvis irritationen vedvarer. Vask det forurenede tøj, inden det bruges igen.
Hvis hudkontakten er svær, skal den vaskes med et desinfektionsmiddel og sæbe og dække den forurenede hud med en antibakteriel creme..
I tilfælde af indånding
Det tilrådes at lade offeret hvile i et godt ventileret område. Hvis inhalationen er svær, skal offeret evakueres til et sikkert område hurtigst muligt. Løsn stramt tøj såsom en skjortekrave, bælte eller slips. Hvis offeret har svært ved at trække vejret, skal der gives ilt.
Hvis offeret ikke trækker vejret, udføres genoplivning fra mund til mund. Husk altid, at det kan være farligt for den person, der yder hjælp til at give genoplivning fra mund til mund, når det indåndede materiale er giftigt, smitsomt eller ætsende..
Fremkald ikke opkastning ved indtagelse. Løsn stramt tøj såsom skjortekraver, bælter eller bånd. Hvis offeret ikke trækker vejret, skal du udføre genoplivning fra mund til mund.
I alle tilfælde skal du straks søge lægehjælp..
Ansøgninger
Bromsyre bruges som et stærkt oxidationsmiddel i laboratoriereaktioner. Det bruges til at producere kemiske forbindelser såsom iodater, chlorsyre, tetraihonsyre blandt andre..
Det bruges også til fremstilling af bromater såsom jern, bly, mangan og kviksølvbromat blandt andre..
Bromsyre fungerer som et vigtigt mellemprodukt i Bélousov-Zhabotinsky-reaktionen (Morris, 2010). Denne reaktion er et eksempel på kemiske ure og illustrerer en termodynamisk ikke-ligevægtsreaktion.
Oscillationsreaktionen katalyseres af cerium og er iboende forbundet med kemien af bromoxosyrer HBrOx. Den voksende interesse for ikke-lineære kemiske systemer har givet stærke incitamenter til at studere kemiens brom..
I Belousov-Zhabotinsky-reaktionen er de involverede bromforbindelser hypobromsyre HOBr, bromsyre HOBrO og bromsyre HBrO3 (3) (Rainer Glaser, 2013).
Disse typer reaktioner er vigtige for teoretisk kemi. De viser, at kemiske reaktioner ikke behøver at være domineret af ligevægtstermodynamisk opførsel.
Referencer
- Bromsyre. (S.F.). Gendannet fra chemyq.com.
- EMBL-EBI. (2008, 16. maj). bromsyre. Gendannet fra ebi.ac.uk.
- EMBL-EBI. (2014, 28. juli). klorsyre. Gendannet fra ebi.ac.uk.
- Morris, S. (2010, 23. januar). Belousov Zhabotinsky-reaktion 8 x normal hastighed. Gendannet fra youtubecom.
- Mine foretrukne kemikalier. (S.F.). Gendannet fra bromicacid.com.
- National Center for Biotechnology Information. (2017, 11. marts). PubChem Compound Database; CID = 24445 ,. Hentet fra PubChem.
- Rainer Glaser, M. D. (2013). Hvorfor surheden af bromsyre virkelig betyder noget for kinetiske modeller af Belousov-Zhabotinsky oscillerende kemiske reaktioner. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Bromsyre. Gendannet fra chemspider.com.
- Watts, H. (1870). A Dictionary of Chemistry and Allied Branches of Other Sciences, bind 1. London: longmans, green and co.



Endnu ingen kommentarer