
Hyposulfurøse syreformler, egenskaber og anvendelser
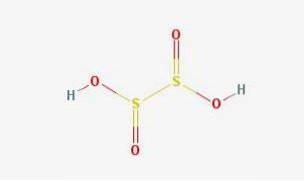
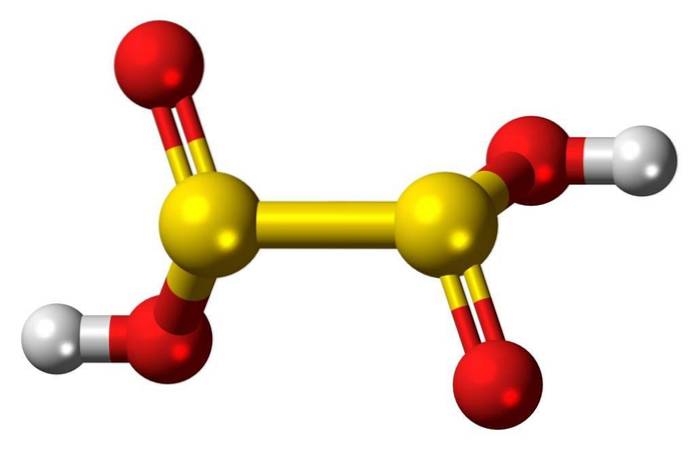
Det svovlsyre eller dithionøs syre er ukendt, ustabil i ren form, har ingen uafhængig eksistens og er ikke blevet påvist i vandig opløsning.
Teoretisk ville det være en relativt svag syre, der kan sammenlignes med svovlsyre, H2SO3. Kun dets salte kendes, dithionitterne, som er stabile og kraftige reduktionsmidler. Natriumsaltet af dithionsyre er natriumdithionit.

- Formler
| dithionøs syre | dionionitanion | natriumdithionit | |
| Formler | H2S2O4 | S2O42− | Na2S204 |
- CAS: 20196-46-7 hyposulfurøs (eller dithionøs) syre
- CAS: 14844-07-6 hyposulfurøs syre (eller dithionøs, ion)
- CAS: 7775-14-6 natriumdithionit (natriumsalt af dithionsyre)
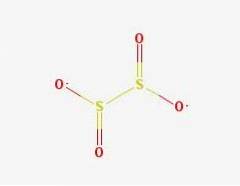
2D struktur
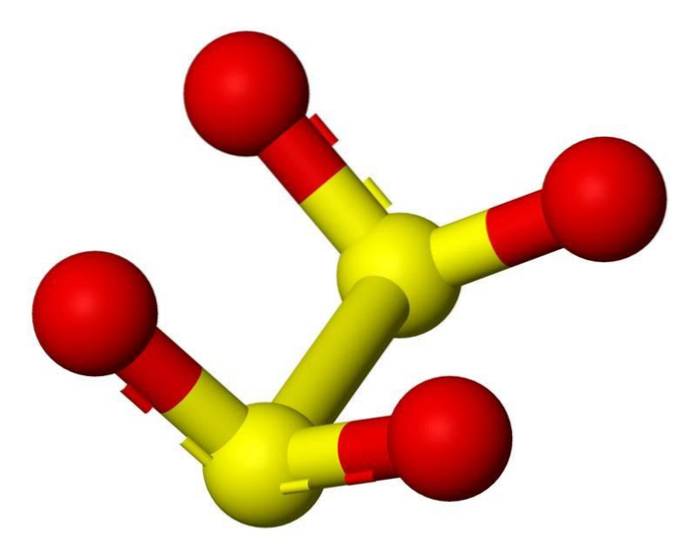
3D-struktur
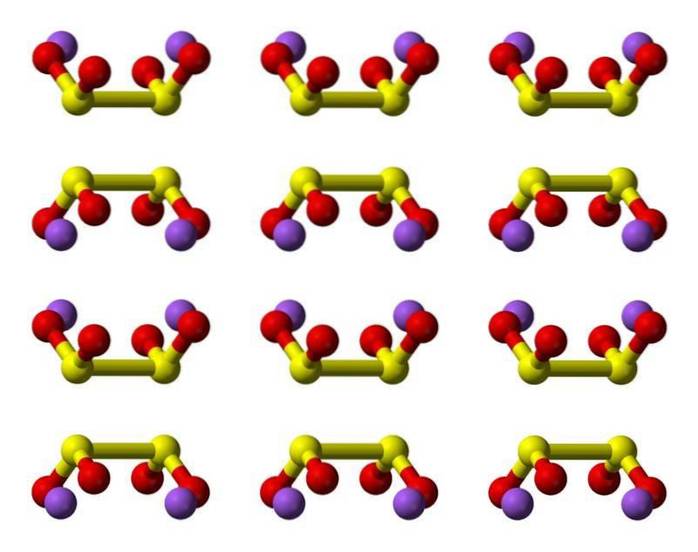
Egenskaber
Fysiske og kemiske egenskaber
| dithionøs syre | dionionitanion | natriumdithionit | |
| Udseende: | . | . | Hvidt til off-white krystallinsk pulver |
| . | . | Lette citronflager | |
| Lugt: | . | . | Svag svovlluft |
| Molekylær vægt: | 130,132 g / mol | 128,116 g / mol | 174,096 g / mol |
| Kogepunkt: | . | . | Det nedbrydes |
| Smeltepunkt: | . | . | 52 ° C |
| Massefylde: | . | . | 2,38 g / cm3 (vandfri) |
| Vandopløselighed | . | . | 18,2 g / 100 ml (vandfri, 20 ° C) |
Hyposvovlsyre er en svovloxosyre med den kemiske formel H2S2O4.
Svovloxosyrer er kemiske forbindelser, der indeholder svovl, ilt og brint. Imidlertid er nogle af dem kun kendt fra deres salte (såsom hyposvovlsyre, dithionsyre, disulfidsyre og svovlsyre).
Blandt de strukturelle egenskaber ved oxosyrerne, der er blevet karakteriseret, har vi:
- Tetrahedral svovl, når det koordineres med ilt
- Bro- og terminal iltatomer
- Terminal peroxogrupper
- S = S terminaler
- Strenge af (-S-) n
Svovlsyre er den bedst kendte svovloxosyre og den vigtigste industrielt.
Dithionitanionen ([S2O4] 2-) er en oxoanion (en ion med den generiske formel AXOY z-) af svovl formelt afledt af dithionsyre.
Dithionitioner gennemgår både sur og alkalisk hydrolyse til henholdsvis thiosulfat og bisulfit og sulfit og sulfid:
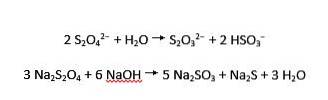
Natriumsaltet af dithionøs syre er natriumdithionit (også kendt som natriumhydrosulfit).
Natriumdithionit er et hvidligt til lysegult krystallinsk pulver, der har en lugt svarende til svovldioxid..
Det opvarmes spontant ved kontakt med luft og fugtighed. Denne varme kan være nok til at antænde de omgivende brændbare materialer..
Ved langvarig udsættelse for ild eller intens varme kan beholdere med dette materiale briste voldsomt..
Det bruges som reduktionsmiddel og som blegemiddel. Det bruges og til blegning af papirmasse og til farvning. Det bruges også til at reducere nitrogruppen til en aminogruppe i organiske reaktioner..
Selvom det er stabilt under de fleste betingelser, nedbrydes det i varmt vand og syreopløsninger.
Det kan opnås fra natriumbisulfit ved følgende reaktion:
2 NaHSO3 + Zn → Na2S2O4 + Zn (OH) ²
Luft- og vandreaktioner
Sodiumdithionit er et brændbart fast stof, der langsomt nedbrydes ved kontakt med vand eller vanddamp og danner thiosulfater og bisulfitter..
Denne reaktion producerer varme, som yderligere kan fremskynde reaktionen eller få omgivende materialer til at brænde. Hvis blandingen er begrænset, kan nedbrydningsreaktionen resultere i trykforsyning af beholderen, som kan briste kraftigt. Opholder sig i luften oxiderer den langsomt og genererer giftige svovldioxidgasser.
Brandfare
Sodiumdithionit er et brandfarligt og brændbart materiale. Kan antændes ved kontakt med fugtig luft eller fugt. Det kan brænde hurtigt med blusseffekt. Kan reagere kraftigt eller eksplosivt i kontakt med vand.
Kan nedbrydes eksplosivt, når det opvarmes eller er involveret i brand. Det kan tændes igen, når ilden er slukket. Afstrømning kan skabe brand eller eksplosionsfare. Beholdere kan eksplodere, når de opvarmes.
Sundhedsfare
Ved kontakt med ild vil natriumdithionit producere irriterende, ætsende og / eller giftige gasser. Indånding af nedbrydningsprodukter kan forårsage alvorlig personskade eller død. Kontakt med stoffet kan forårsage alvorlige forbrændinger af hud og øjne. Afstrømning fra brandkontrol kan forårsage forurening.
Ansøgninger
Dithionitionen anvendes ofte sammen med et kompleksdannende middel (f.eks. Citronsyre) til at reducere jern (III) oxyhydroxid til opløselige jern (II) forbindelser og fjerne amorfe jernholdige mineralfaser (III) i jordanalyse (selektiv ekstraktion ).
Dithionit øger opløseligheden af jern. Takket være den stærke affinitet af dithionitionen til bivalente og trivalente metalkationer, bruges den som et chelateringsmiddel..
Nedbrydningen af dithionit producerer reducerede svovlarter, der kan være meget aggressive for korrosionen af stål og rustfrit stål..
Blandt anvendelserne af natriumdithionit har vi:
I branchen
Denne forbindelse er et vandopløseligt salt og kan anvendes som reduktionsmiddel i vandige opløsninger. Det bruges som sådan i nogle industrielle farvningsprocesser, hovedsageligt dem, der involverer svovlfarvestoffer og karfarvestoffer, hvor et vanduopløseligt farvestof kan reduceres til et vandopløseligt alkalimetalsalt (for eksempel indigofarvestoffet).
De reducerende egenskaber ved natriumdithionit fjerner også overskydende farvestof, resterende oxid og uønskede pigmenter og forbedrer således den samlede farvekvalitet..
Natriumdithionit kan også bruges til vandbehandling, gasrensning, rengøring og ekstraktion. Det kan også bruges i industrielle processer som et sulfoneringsmiddel eller en kilde til natriumion.
Ud over tekstilindustrien anvendes denne forbindelse i industrier relateret til læder, mad, polymerer, fotografering og mange andre. Anvendes også som blegemiddel i organiske reaktioner.
I de biologiske videnskaber
Natriumdithionit bruges ofte i fysiologiske eksperimenter som et middel til at reducere redoxpotentialet i opløsninger..
I geologiske videnskaber
Natriumdithionit bruges ofte i jordkemiske eksperimenter til at bestemme den mængde jern, der ikke er inkorporeret i primære silikatmineraler..
Sikkerhed og risici
Faresætninger fra det globalt harmoniserede system for klassificering og mærkning af kemikalier (GHS)
Det globalt harmoniserede system til klassificering og mærkning af kemikalier (GHS) er et internationalt aftalt system, der er oprettet af FN og designet til at erstatte de forskellige klassificerings- og mærkningsstandarder, der anvendes i forskellige lande ved hjælp af ensartede kriterier globalt..
Risikoklasserne (og deres tilsvarende GHS-kapitel), klassificerings- og mærkningsstandarder og anbefalinger for natriumdithionit er som følger (European Chemicals Agency, 2017; FN, 2015; PubChem, 2017):



Referencer
- Benjah-bmm27, (2006). En kugle-og-stick-model af dithionitionen [billede] Gendannet fra wikipedia.org.
- Drozdova, Y., Steudel, R., Hertwig, R. H., Koch, W., & Steiger, T. (1998). Strukturer og energier af forskellige isomerer af dithionøs syre, H2S2O4 og dens anion HS2O4-1. Journal of Physical Chemistry A, 102 (6), 990-996. Gendannet fra: mycrandall.ca
- Det Europæiske Kemikalieagentur (ECHA). (2017). Resumé af klassificering og mærkning. Harmoniseret klassificering - Bilag VI til forordning (EF) nr. 1272/2008 (CLP-forordningen). Natriumdithionit, natriumhydrosulfit. Hentet den 2. februar 2017 fra: echa.europa.eu
- Jynto (diskussion), (2011). Dithionøs-syre-3D-kugler [billede] Gendannet fra: https://da.wikipedia.org/wiki/Dithionous_acid#/media/File:Dithionous-acid-3D-balls.png
- LHcheM, (2012). Prøve af natriumdithionit [billede] Gendannet fra: wikipedia.org.
- Mills, B. (2009). Sodium-dithionite-xtal-1992-3D-balls [billede] Gendannet fra: wikipedia.org.
- FN (2015). Globalt harmoniseret system til klassificering og mærkning af kemikalier (GHS) Sjette reviderede udgave. New York, EU: FN-publikation. Gendannet fra: unece.orgl
- National Center for Biotechnology Information. PubChem Compound Database. (2017). Dithionit. Bethesda, MD, EU: National Library of Medicine. Gendannet fra: pubchem.ncbi.nlm.nih.gov.
- National Center for Biotechnology Information. PubChem Compound Database. (2017). Dithionøs syre. Bethesda, MD, EU: National Library of Medicine. Gendannet fra: nih.gov.
- National Center for Biotechnology Information. PubChem Compound Database. (2017). Natriumdithionit. Bethesda, MD, EU: National Library of Medicine. Gendannet fra: nih.gov.
- National Oceanic and Atmospheric Administration (NOAA). CAMEO Chemicals. (2017). Kemisk datablad. Natriumdithionit. Silver Spring, MD. EU; Gendannet fra: cameochemicals.noaa.gov
- PubChem, (2016). Dithionit [billede] Gendannet fra: nih.gov.
- PubChem, (2016). Dithionit [billede] Gendannet fra: nih.gov.
- PubChem, (2016). Dithionøs syre [billede] Gendannet fra: nih.gov.
- Wikipedia. (2017). Dithionit. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Dithionøs_syre. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Oxyanion. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Natriumdithionit. Hentet 2. februar 2017 fra: wikipedia.org.
- Wikipedia. (2017). Svovloxosyre. Hentet 2. februar 2017 fra: wikipedia.org.



Endnu ingen kommentarer