
Salpetersyre (HNO2) struktur, egenskaber, syntese

Det salpetersyre er en svag, uorganisk syre, hvis kemiske formel er HNOto. Det findes hovedsageligt i vandig opløsning med en lyseblå farve. Det er meget ustabilt og nedbrydes hurtigt i nitrogenoxid, NO og salpetersyre, HNO3.
Det findes normalt i vandig opløsning i form af nitrit. Det kommer også naturligt fra atmosfæren som et resultat af omsætningen af nitrogenoxid med vand. Der, specifikt i troposfæren, griber salpetersyre ind i reguleringen af ozonkoncentrationen.

En HNO-løsning er vist på billedet ovenforto hvor den karakteristiske lyseblå farve af denne syre værdsættes. Det syntetiseres ved opløsning af nitrogentrioxid, NtoELLER3, i vand. Ligeledes er det produktet af forsuring af natriumnitritopløsninger ved lave temperaturer..
HNOto Det har ringe kommerciel brug, idet det bruges i form af nitrit til konservering af kød. På den anden side bruges det til fremstilling af azofarvestoffer.
Det bruges sammen med natriumthiosulfat til behandling af patienter med natriumcyanidforgiftning. Men det er et mutagent middel, og det menes, at det kan forårsage substitutioner i baserne af DNA-kæder gennem en oxidativ deaminering af cytosin og adenin..
Salpetersyre har en dobbelt adfærd, da den kan opføre sig som et oxidationsmiddel eller som et reduktionsmiddel; det vil sige, det kan reduceres til NO eller Nto, u oxiderer til HNO3.
Artikelindeks
- 1 Strukturen af salpetersyre
- 2 egenskaber
- 2.1 Kemiske navne
- 2.2 Fysisk beskrivelse
- 2.3 Molekylvægt
- 2.4 Dissociationskonstant
- 2.5 Smeltepunkt
- 2.6 Kogepunkt
- 2.7 Saltdannelse
- 2.8 Brandpotentiale
- 2.9 Nedbrydning
- 2.10 Reduktionsmiddel
- 2.11 Oxiderende middel
- 3 Nomenklatur
- 4 Syntese
- 5 risici
- 6 anvendelser
- 6.1 Produktion af diazoniumsalte
- 6.2 Fjernelse af natriumazid
- 6.3 Syntese af oximer
- 6.4 I sin saltvandsform
- 7 Referencer
Salpetersyrestruktur
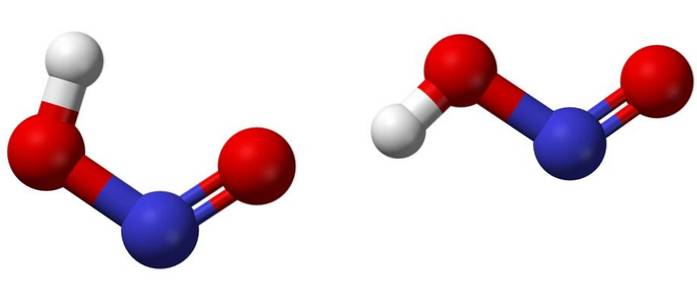
Det øverste billede viser den lystensyres molekylære struktur ved hjælp af en kugle- og stavmodel. Nitrogenatomet (blå kugle) er placeret i midten af strukturen og danner en dobbeltbinding (N = O) og en enkeltbinding (N-O) med iltatomerne (røde kugler).
Bemærk, at hydrogenatomet (hvid kugle) er bundet til en af oxygenerne og ikke direkte til nitrogen. Så vel vidende dette er strukturformlen for HNOto er [HO-N = O] eller [NO (OH)], og der er ingen sådan H-N-binding (som den kemiske formel kan antyde).
Molekylerne på billedet svarer til dem i en gasfase; i vand er de omgivet af vandmolekyler, som kan acceptere hydrogenionen (svagt) til dannelse af NO-ionerto- og H3ELLER+.
Deres strukturer kan have to former: cis eller trans, kaldet geometriske isomerer. I cis-isomeren formørkes H-atomet af det tilstødende iltatom; mens i trans-isomeren er begge i anti- eller modsatte positioner.
I cis-isomeren er dannelsen af en intramolekylær hydrogenbro (OH-NO) sandsynligvis, hvilket kan forstyrre de intermolekylære (ONOH-ONOH)..
Ejendomme
Kemiske navne
-Salpetersyre
-Dioxonitric syre (III)
-Nitrosylhydroxid
-Hydroxid oxidonitrogen (IUPAC systematisk navn)
Fysisk beskrivelse
Lyseblå væske svarende til nitritopløsning.
Molekylær vægt
47,013 g / mol.
Dissociation konstant
Det er en svag syre. Dens pKa er 3,35 ved 25 ºC.
Smeltepunkt
Det er kun kendt i opløsning. Derfor kan dets smeltepunkt ikke beregnes, og dets krystaller kan heller ikke isoleres..
Kogepunkt
Da det ikke eksisterer rent, men i vand, er målingerne af denne egenskab ikke nøjagtige. På den ene side afhænger det af koncentrationen af HNOto, og på den anden producerer dens opvarmning sin nedbrydning. Derfor rapporteres der ikke om et nøjagtigt kogepunkt..
Saltdannelse
Danner vandopløselige nitriter med Li+, Na+, K+, ACto+, Hrto+, Bato+. Men det danner ikke salte med polyvalente kationer, såsom: Al3+ og / eller væreto+ (på grund af dens høje ladningstæthed). Det er i stand til at danne stabile estere med alkoholer.
Brandpotentiale
Det er brandfarligt ved kemiske reaktioner. Kan eksplodere ved kontakt med phosphortrichlorid.
Nedbrydning
Det er en meget ustabil forbindelse, og i vandig opløsning nedbrydes den til nitrogenoxid og salpetersyre:
2 HNOto => NEJto + NO + HtoELLER
4 HNOto => 2 HNO3 + NtoO + HtoELLER
Reduktionsmiddel
Salpetersyre i vandig opløsning forekommer i form af nitritioner, NOto-, som gennemgår forskellige reduktionsreaktioner.
Reagerer med I-ioner- og troto+, i form af kaliumnitrit til dannelse af nitrogenoxid:
2 KNOto + KI + HtoSW4 => Jegto + 2 NO + 2 HtoO + KtoSWto
Kaliumnitrit i nærværelse af tinioner reduceres til dannelse af nitrogenoxid:
KNOto + 6 HCI + 2 SnClto => 2 SnCl4 + NtoO + 3 HtoO + 2 KCl
Kaliumnitrit reduceres med Zn i et alkalisk medium og danner ammoniak:
5 timertoO + KNOto + 3 Zn => NH3 + KOH + 3 Zn (OH)to
Oxiderende middel
Udover at være et reduktionsmiddel kan salpetersyre gribe ind i oxidationsprocesser. For eksempel: det oxiderer hydrogensulfid, bliver til nitrogenoxid eller ammoniak afhængigt af surheden i mediet, hvor reaktionen finder sted.
2 HNOto + HtoS => S + 2 NO + 2 HtoELLER
HNOto + 3 HtoS => S + NH3 + 2 timertoELLER
Salpetersyre i et surt pH-medium kan oxidere iodidion til iod.
HNOto + jeg- + 6 timer+ => 3 Ito + NH3 + 2 timertoELLER
Det kan også fungere som et reduktionsmiddel ved at virke på Cuto+, hvilket giver anledning til salpetersyre.
Nomenklatur
Til HNOto Det kan gives andre navne, der afhænger af typen af nomenklatur. Salpetersyre svarer til den traditionelle nomenklatur; dioxonitronsyre (III) til stamnomenklaturen og hydrogendioxonitrat (III), til det systematiske.
Syntese
Salpetersyre kan syntetiseres ved at opløse nitrogentrioxid i vand:
NtoELLER3 + HtoO => 2 HNOto
En anden fremgangsmåde til fremstilling består af reaktionen af natriumnitrit, NaNO3, med mineralsyrer såsom saltsyre og brombrintesyre. Reaktionen udføres ved en lav temperatur, og salpetersyren forbruges in situ..
Storebror3 + H+ => HNOto + Na+
H ionen+ kommer fra enten HCI eller HBr.
Risici
På grund af dets egenskaber og kemiske egenskaber er der kun få oplysninger om de direkte toksiske virkninger af HNO.to. Måske er nogle skadelige virkninger, der menes at være produceret af denne forbindelse, faktisk forårsaget af salpetersyre, som kan produceres ved nedbrydning af salpetersyre.
Det bemærkes, at HNOto kan have skadelige virkninger på luftvejene og være i stand til at fremkalde irriterende symptomer hos astmatiske patienter.
I form af natriumnitrit reduceres det med deoxyhemoglobin, der producerer nitrogenoxid. Dette er en kraftig vasodilator, der producerer afslapning af vaskulære glatte muskler, der estimerer en LD50-dosis på 35 mg / kg til oral indtagelse hos mennesker..
Natriumnitritoksicitet manifesterer sig med kardiovaskulært sammenbrud, efterfulgt af svær hypotension på grund af vasodilatorvirkningen af nitrogenoxid, produceret af nitrit..
Kvælstofdioxid, NOto, til stede i forurenet luft (smog), under visse betingelser kan det forårsage salpetersyre; som igen kan reagere med aminer til dannelse af nitrosaminer, en gamma af kræftfremkaldende forbindelser.
En lignende reaktion forekommer med cigaretrøg. Der er fundet nitrosaminrester, der klæber til indersiden af rygernes køretøjer.
Ansøgninger
Produktion af diazoniumsalte
Salpetersyre anvendes i industrien til produktion af diazoniumsalte gennem reaktion med aromatiske aminer og phenoler.
HNOto + ArNHto + H+ => ArN = NAr + HtoELLER
Diazoniumsalte anvendes i organiske syntesereaktioner; for eksempel i Sandmeyer-reaktionen. I denne reaktion er substitutionen af en aminogruppe (HtoN-), i en primær aromatisk amin, af Cl-grupperne-, Br- og CN-. For at opnå disse aromatiske produkter kræves kobbersalt.
Diazoniumsalte kan danne lyse azoforbindelser, der anvendes som farvestoffer og fungerer også som en kvalitativ test for tilstedeværelsen af aromatiske aminer..
Fjernelse af natriumazid
Salpetersyre anvendes til fjernelse af natriumazid (NaN3), som er potentielt farligt på grund af dens tendens til at eksplodere.
2 NaN3 + 2 HNOto => 3 Nto + 2 NO + 2 NaOH
Syntese af oximer
Salpetersyre kan reagere med ketongrupper til dannelse af oximer. Disse kan oxideres til dannelse af carboxylsyrer eller reduceres til dannelse af aminer..
Denne proces anvendes til kommerciel fremstilling af adipinsyre, den monomer, der anvendes til produktion af nylon. Det er også involveret i produktionen af polyurethan, og dets estere er blødgørere, hovedsageligt PVC.
I sin saltvandsform
Salpetersyre i form af natriumnitrit anvendes til behandling og konservering af kød; da det forhindrer bakterievækst og er i stand til at reagere med myoglobin og producerer en mørkerød farve, der gør kødet mere attraktivt til forbrug.
Det samme salt anvendes sammen med natriumthiosulfat til intravenøs behandling af natriumcyanidforgiftning..
Referencer
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10th udgave.). Wiley plus.
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- PubChem. (2019). Salpetersyre. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Softschools. (2019). Salpetersyre. Gendannet fra: Softschools.com
- Wikipedia. (2019). Salpetersyre. Gendannet fra: en.wikipedia.org
- Royal Society of Chemistry. (2015). Salpetersyre. Gendannet fra: chemspider.com
- New World Encyclopedia. (2015). Salpetersyre. Gendannet fra: newworldencyclopedia.org
- DrugBank. (2019). Salpetersyre. Gendannet fra: drugbank.ca
- Kemisk formulering. (2018). HNOto. Gendannet fra: formulacionquimica.com

Endnu ingen kommentarer