
Klorhistorie, egenskaber, struktur, risici, anvendelser
Det klor Det er et kemisk element, der er repræsenteret ved symbolet Cl. Det er det andet af halogenerne, der er placeret under fluor, og er også det tredje mest elektronegative element af alle. Navnet stammer fra sin gulgrønne farve, som er mere intens end fluor.
Når nogen hører dit navn, er det første, de tænker på, blegeprodukter til tøj og vandet i svømmehaller. Selvom klor fungerer effektivt i sådanne eksempler, er det ikke dets gas, men dets forbindelser (især hypochlorit), der udøver blegnings- og desinfektionsvirkningen..

Ovenstående billede viser en rund kolbe med klorgas. Densiteten er større end luftens, hvilket forklarer, hvorfor den forbliver i kolben og ikke flygter ud i atmosfæren; som det sker med andre lettere gasser, for eksempel helium eller nitrogen. I denne tilstand er det et meget giftigt stof, da det producerer saltsyre i lungerne..
Derfor har elementært eller gasformigt klor ikke mange anvendelser, bortset fra i nogle synteser. Imidlertid dækker dets forbindelser, det være sig salte eller klorerede organiske molekyler, et godt repertoire af anvendelser, der går ud over svømmehaller og ekstremt hvidt tøj..
Ligeledes findes dets atomer i form af chloridioner i vores kroppe, der regulerer niveauerne af natrium, calcium og kalium såvel som i mavesaft. Ellers ville indtagelsen af natriumchlorid være endnu mere dødelig.
Klor produceres ved elektrolyse af saltvand, der er rig på natriumchlorid, en industriel proces, hvor natriumhydroxid og hydrogen også opnås. Og fordi havene er en næsten uudtømmelig kilde til dette salt, er de potentielle reserver for dette element i hydrosfæren meget store..
Artikelindeks
- 1 Historie
- 1.1 Første tilgang
- 1.2 Opdagelse
- 1.3 Oxymuratinsyre
- 1.4 Anerkendelse som et element
- 2 Fysiske og kemiske egenskaber
- 2.1 Fysisk udseende
- 2.2 Atomnummer (Z)
- 2.3 Atomvægt
- 2.4 Kogepunkt
- 2.5 Smeltepunkt
- 2.6 Tæthed
- 2.7 Fusionsvarme
- 2.8 Fordampningsvarme
- 2.9 Molær varmekapacitet
- 2.10 Opløselighed i vand
- 2.11 Damptryk
- 2.12 Elektronegativitet
- 2.13 Ioniseringsenergier
- 2.14 Varmeledningsevne
- 2.15 Isotoper
- 2.16 oxidationstal
- 3 Struktur og elektronisk konfiguration
- 3.1 Klormolekyle
- 3.2 Intermolekylære interaktioner
- 4 Hvor kan man finde og hente
- 4.1 Chloridsalte
- 4.2 Elektrolyse af saltlage
- 4.3 Syreopløsning af pyrolusit
- 5 legeringer
- 6 risici
- 7 anvendelser
- 7.1 Syntese
- 7.2 Biologiske stoffer
- 7.3 Kemiske våben
- 7.4 Desinfektionsmiddel
- 7.5 Blegemiddel
- 7.6 Polyvinylchlorid
- 8 Referencer
Historie
Første tilgange
På grund af den høje reaktivitet af klorgas, antog gamle civilisationer aldrig dens eksistens. Imidlertid var dens forbindelser en del af menneskehedens kultur siden oldtiden; dens historie begyndte at være knyttet til almindeligt salt.
På den anden side opstod klor fra vulkanudbrud, og når nogen opløste guld i aqua regia; Men ingen af disse første tilgange var engang nok til at formulere ideen om, at den gulgrønne gas var et element eller en forbindelse.
Opdagelse
Opdagelsen af klor tilskrives den svenske kemiker Carl Wilhelm Scheele, som i 1774 udførte reaktionen mellem mineralet pyrolusit og saltsyre (dengang kaldet muriatsyre).
Scheele får æren, da han var den første videnskabsmand, der undersøgte klorens egenskaber; skønt tidligere anerkendt (1630) af Jan Baptist van Helmont.
Eksperimenterne, som Scheele opnåede sine observationer med, er interessante: han evaluerede klorens blegende virkning på rødlige og blålige blomsterblade såvel som på blade af planter og insekter, der døde øjeblikkeligt..
Ligeledes rapporterede han, at det var meget reaktivt for metaller, dets kvælende lugt og uønskede virkning på lungerne, og at når det blev opløst i vand, steg dets surhed..
Oxymuratinsyre
På det tidspunkt betragtede kemikere enhver forbindelse, der havde ilt, som en syre; så de fejlagtigt troede, at klor måtte være en gasformig oxid. Det er sådan, de kaldte det 'oxymuratinsyre' (muriatsyreoxid), et navn opfundet af den berømte franske kemiker Antoine Lavoisier.
Så i 1809 forsøgte Joseph Louis Gay-Lussac og Louis Jacques Thénard at reducere denne syre med trækul; reaktion, hvormed de opnåede metaller fra deres oxider. På denne måde ønskede de at udvinde det kemiske element i den formodede oxymuratinsyre (som de kaldte 'muriatsyre deflogsticeret luft'.
Dog mislykkedes Gay-Lussac og Thénard i deres eksperimenter; men de havde ret i at overveje muligheden for, at den gulgrønne gas måtte være et kemisk element og ikke en forbindelse.
Anerkendelse som et element
Anerkendelsen af klor som et kemisk element var takket være Sir Humphry Davy, der i 1810 udførte sine egne eksperimenter med kulelektroder og konkluderede, at en sådan oxid af muriatsyre ikke eksisterede..
Og desuden var det Davy, der udtænkte navnet 'klor' for dette element fra det græske ord 'kloros', som betyder gulgrøn..
Da de studerede klorens kemiske egenskaber, viste det sig, at mange af dets forbindelser var saltvandede; derfor kaldte de det 'halogen', hvilket betyder saltformer. Derefter blev udtrykket halogen brugt med de andre grundstoffer i samme gruppe (F, Br og I).
Michael Faraday formåede endda at flyde kloren til et fast stof, der på grund af at være forurenet med vand dannede hydratet CltoHtoELLER.
Resten af historien om klor er knyttet til dets desinfektionsmiddel og blegningsegenskaber, indtil udviklingen af den industrielle proces med elektrolyse af saltvand til at producere enorme mængder klor..
Fysiske og kemiske egenskaber
Fysisk fremtoning
Det er en tæt, uigennemsigtig, gulgrøn gas med en irriterende, skarp lugt (en superforbedret version af kommercielt klor) og er også ekstremt giftig..
Atomnummer (Z)
17
Atomvægt
35,45 u.
Medmindre andet er angivet, svarer alle andre egenskaber til mængder målt for molekylært chlor, Clto.
Kogepunkt
-34,04 ºC
Smeltepunkt
-101,5 ºC
Massefylde
-Under normale forhold 3,2 g / l
-Lige ved kogepunktet 1,5624 g / ml
Bemærk, at flydende klor er cirka fem gange så tæt som dets gas. Densiteten af dens damp er også 2,49 gange større end luftens. Derfor har klor i det første billede ikke en tendens til at flygte fra den runde kolbe, da den er tættere end luft, den er placeret i bunden. Denne egenskab gør det til en endnu farligere gas..
Fusionsvarme
6,406 kJ / mol
Fordampningsvarme
20,41 kJ / mol
Molær varmekapacitet
33,95 J / (mol K)
Vandopløselighed
1,46 g / 100 ml ved 0 ºC
Damptryk
7,67 atm ved 25 ° C Dette tryk er relativt lavt sammenlignet med andre gasser.
Elektronegativitet
3.16 på Pauling-skalaen.
Ioniseringsenergier
-Først: 1251,2 kJ / mol
-Andet: 2298 kJ / mol
-Tredje: 3822 kJ / mol
Varmeledningsevne
8,9 10-3 W / (mK)
Isotoper
Klor forekommer i naturen primært som to isotoper: 35Cl, med en overflod på 76%, og 37Cl med en overflod på 24%. Atomvægten (35,45 u) er således et gennemsnit af atommasserne af disse to isotoper med deres respektive overflodsprocentdele..
Alle radioisotoper af klor er kunstige, blandt hvilke 36Cl som den mest stabile med en halveringstid på 300.000 år.
Oxidationsnumre
Klor kan have forskellige oxidationsnumre eller -tilstande, når det er en del af en forbindelse. At være et af de mest elektronegative atomer i det periodiske system, har det normalt negative oxidationstal; undtagen når det kommer over ilt eller fluor, i hvis henholdsvis oxider og fluorider, skal det "miste" elektroner.
I deres oxidationstal antages eksistensen eller tilstedeværelsen af ioner med samme ladningsstørrelse. Således har vi: -1 (Cl-, den berømte kloranion), +1 (Cl+), +2 (Clto+), +3 (Cl3+), +4 (Cl4+), +5 (Cl5+), +6 (Cl6+) og +7 (Cl7+). Af dem alle er -1, +1, +3, +5 og +7 de mest almindelige, der findes i klorerede forbindelser..
For eksempel i ClF og ClF3 oxidationstallene for klor er +1 (Cl+F-) og +3 (Cl3+F3-). I CltoEller dette er +1 (Clto+ELLERto-); mens han var i ClOto, CltoELLER3 og CltoELLER7, er +4 (Cl4+ELLERtoto-), +3 (Clto3+ELLER3to-) og +7 (Clto7+ELLER7to-).
I alle klorider har klor på den anden side et oxidationsnummer på -1; som i tilfældet med NaCl (Na+Cl-), hvor det er gyldigt at sige, at Cl eksisterer- givet saltets ioniske natur.
Struktur og elektronisk konfiguration
Klormolekyle

Kloratomer i deres jordtilstand har følgende elektroniske konfiguration:
[Ne] 3sto 3p5
Derfor har hver af dem syv valenselektroner. Medmindre de er overbelastet med energi, vil der være individuelle Cl-atomer i rummet, som grønne kugler. Imidlertid er deres naturlige tendens til at danne kovalente bindinger mellem dem for at fuldføre deres valensokter..
Bemærk, at de næppe har brug for en elektron for at have otte valenselektroner, så de danner en enkelt simpel binding; dette er den, der forbinder to Cl-atomer for at skabe Cl-molekyletto (øverste billede), Cl-Cl. Derfor er klor under normale og / eller jordbundsforhold en molekylær gas; ikke monatomisk, som med ædelgasser.
Intermolekylære interaktioner
Cl-molekyletto det er homonukleært og apolært, så dets intermolekylære interaktioner styres af Londons spredekræfter og dets molekylære masser. I gasfasen er afstanden Clto-Clto den er relativt kort sammenlignet med andre gasser, der, føjet til dens masse, gør den til en gas tre gange tættere end luft.
Lys kan begejstre og fremme elektroniske overgange inden for Cl's molekylære orbitalerto; derfor vises den karakteristiske gulgrønne farve. Denne farve intensiveres i flydende tilstand og forsvinder derefter delvist, når den størkner.
Når temperaturen falder (-34 ºC), Cl-molekylerneto mister kinetisk energi og afstand Clto-Clto falder; derfor samles disse og ender med at definere det flydende chlor. Det samme sker, når systemet afkøles endnu mere (-101 ºC), nu med Cl-molekylerneto så tæt sammen, at de definerer en orthorhombisk krystal.
Det faktum, at der findes klorkrystaller, er tegn på, at deres spredningskræfter er retningsbestemte nok til at skabe et strukturelt mønster; det vil sige molekylære lag af Clto. Adskillelsen af disse lag er sådan, at deres struktur ikke ændres, selv under et tryk på 64 GPa, og de udviser heller ikke elektrisk ledning..
Hvor kan man finde og få
Chloridsalte

Klor i gasform kan ikke findes nogen steder på jordens overflade, da det er meget reaktivt og har tendens til at danne klorider. Disse klorider er godt diffunderet gennem jordskorpen, og desuden beriger de havene og havene efter millioner af år med at blive skyllet væk af regnvejrene..
Af alle klorider er NaCl af mineralet halit (øverste billede) det mest almindelige og rigelige; efterfulgt af mineralerne silvin, KCl og carnalite, MgCltoKCl 6HtoO. Når vandmasser fordamper på grund af Solens virkning, efterlader de ørkensalt-søer, hvorfra NaCl direkte kan ekstraheres som råmateriale til produktion af klor..
Elektrolyse af saltlage
NaCl opløses i vand til dannelse af en saltopløsning (26%), der udsættes for elektrolyse i en chloralkalicelle. Der finder to halvreaktioner sted i anode- og katodeafdelingen:
2Cl-(ac) => Clto(g) + 2e- (Anode)
2HtoO (l) + 2e- => 2OH-(ac) + Hto(g) (katode)
Og den globale ligning for begge reaktioner er:
2NaCl (aq) + 2HtoO (l) => 2NaOH (aq) + Hto(g) + Clto(g)
Efterhånden som reaktionen forløber, Na-ioner+ dannet ved anoden migrerer ind i katodeafdelingen gennem en permeabel asbestmembran. Af denne grund er NaOH på højre side af den globale ligning. Begge gasser, Clto og Hto, indsamles fra henholdsvis anoden og katoden.
Billedet nedenfor illustrerer, hvad der netop blev skrevet:
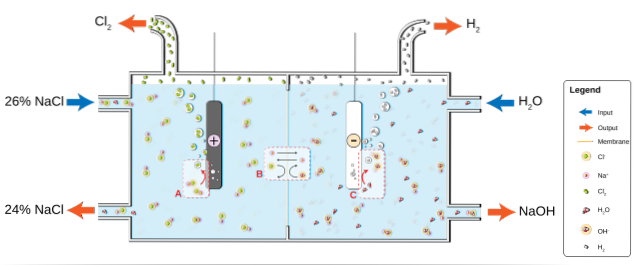
Bemærk, at koncentrationen af saltvand i slutningen falder med 2% (den går fra 24 til 26%), hvilket betyder, at en del af dens anioner Cl- originaler blev transformeret til Cl-molekylerto. I sidste ende har industrialiseringen af denne proces givet en metode til at producere klor, brint og natriumhydroxid.
Syreopløsning af pyrolusit
Som nævnt i historikafsnittet kan chlorgas produceres ved opløsning af pyrolusitmineralprøver med saltsyre. Følgende kemiske ligning viser produkter opnået ved reaktionen:
MnOto(s) + 4HCl (aq) => MnClto(aq) + 2HtoO (l) + Clto(g)
Legeringer
Klorlegeringer findes ikke af to enkle grunde: Deres gasformige molekyler kan ikke fanges mellem metalliske krystaller, og de er også meget reaktive, så de reagerer straks med metaller for at producere deres respektive klorider..
På den anden side er heller ikke chlorider ønskelige, da de, når de først er opløst i vand, udøver en saltopløsning, der fremmer korrosion i legeringer; og derfor opløses metaller til dannelse af metalchlorider. Korrosionsprocessen for hver legering er forskellig; nogle er mere modtagelige end andre.
Klor er derfor slet ikke et godt additiv til legeringer; ej heller som Clto ej heller som Cl- (og Cl-atomer ville være meget reaktive, så de endda kan eksistere).
Risici
Selvom klorens opløselighed i vand er lav, er det nok at producere saltsyre i fugtigheden i vores hud og øjne, hvilket ender med at korroderer vævene og forårsager alvorlig irritation og endda synstab..
Endnu værre er det at trække vejret sine grønne gule dampe, da det en gang i lungerne genererer syrer igen og beskadiger lungevævet. Med dette oplever personen ondt i halsen, hoste og åndedrætsbesvær på grund af væsker dannet i lungerne.
Hvis der er en klorlækage, er du i en særlig farlig situation: luften kan ikke bare "feje væk" dens dampe; de bliver der, indtil de reagerer eller spredes langsomt.
Ud over dette er det en stærkt oxiderende forbindelse, så forskellige stoffer kan reagere eksplosivt med den ved den mindste kontakt; ligesom ståluld og aluminium. Derfor skal der, hvor der opbevares klor, tages alle de nødvendige overvejelser for at undgå risikoen for brand..
Ironisk nok, mens klorgas er dødelig, er dens chloridanion ikke giftig; Det kan indtages (i moderation), det brænder ikke og reagerer heller ikke undtagen med fluor og andre reagenser.
Ansøgninger
Syntese
Cirka 81% af den klorgas, der produceres årligt, anvendes til syntese af organiske og uorganiske chlorider. Afhængig af graden af kovalens af disse forbindelser kan chlor findes som blotte Cl-atomer i chlorerede organiske molekyler (med C-Cl-bindinger) eller som Cl-ioner- i et par chloridsalte (NaCl, CaClto, MgClto, etc.).
Hver af disse forbindelser har sine egne anvendelser. F.eks. Chloroform (CHCl3) og ethylchlorid (CH3CHtoCl) er opløsningsmidler, der er kommet til at blive brugt som inhalationsanæstetika; dichlormethan (CHtoClto) og carbontetrachlorid (CCl4) er i mellemtiden opløsningsmidler, der er meget anvendte i organiske kemilaboratorier.
Når disse chlorerede forbindelser er flydende, bruges de fleste af tiden som opløsningsmidler til organiske reaktionsmedier..
I andre forbindelser repræsenterer tilstedeværelsen af chloratomer en stigning i dipolmomentet, så de kan interagere i større grad med en polær matrix; en sammensat af proteiner, aminosyrer, nukleinsyrer osv., biomolekyler. Klor har således også en rolle i syntesen af lægemidler, pesticider, insekticider, fungicider osv..
Med hensyn til uorganiske chlorider anvendes de normalt som katalysatorer, råmateriale til opnåelse af metaller ved elektrolyse eller kilder til Cl-ioner.-.
Biologisk
Det gasformige eller elementære klor har ingen rolle i levende væsener andet end at ødelægge deres væv. Dette betyder dog ikke, at dets atomer ikke kan findes i kroppen. For eksempel Cl-ioner- er meget rigelige i det cellulære og ekstracellulære miljø og hjælper med at kontrollere niveauerne af Na-ioner+ og Cato+, for det meste.
På samme måde er saltsyre en del af mavesaften, som mad fordøjes med i maven; dets Cl-ioner-, i selskab med H3ELLER+, definere pH tæt på 1 af disse sekreter.
Kemiske våben
Tætheden af klorgas gør det til et dødbringende stof, når det spildes eller hældes i lukkede eller åbne rum. Da den er tættere end luft, bærer en strøm af den ikke let klor, så den forbliver i lang tid, før den endelig spredes.
I første verdenskrig blev dette klor f.eks. Brugt på slagmarker. Når han var løsladt, sneg han sig ind i skyttegravene for at kvæle soldaterne og tvinge dem til overfladen..
Desinfektionsmiddel

Chlorerede opløsninger, dem, hvor chlorgas er blevet opløst i vand og derefter gjort alkaliske med en buffer, har fremragende desinfektionsegenskaber samt hæmmer vævets forrådnelse. De er blevet brugt til at desinficere åbne sår for at eliminere patogene bakterier.
Poolvand er præcist kloreret for at eliminere bakterier, mikrober og parasitter, der kan have sig i det. Klorgas plejede at blive brugt til dette formål, men dens handling er ret aggressiv. I stedet anvendes natriumhypochloritopløsninger (blegemiddel) eller trichlorisocyanursyre (TCA) tabletter..
Ovennævnte viser, at det ikke er Clto den, der udøver desinficeringsvirkningen, men HCI, hypochloritsyre, der producerer O-radikaler, der ødelægger mikroorganismer.
Blege
Meget svarende til sin desinficerende virkning, blegner klor også materialer, fordi de farvestoffer, der er ansvarlige for farverne, nedbrydes af HClO. Dens klorerede opløsninger er således ideelle til at fjerne pletter fra hvide beklædningsgenstande eller til blegning af papirmasse..
Polyvinylchlorid
Den vigtigste klorforbindelse af alle, der tegner sig for ca. 19% af den resterende klorgasproduktion, er polyvinylchlorid (PVC). Denne plastik har flere anvendelser. Med det fremstilles vandrør, vinduesrammer, væg- og gulvbelægninger, elektriske ledninger, IV-poser, frakker osv..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Klor. Gendannet fra: en.wikipedia.org
- Laura H. et al. (2018). Struktur af fast klor ved 1,45 GPaZeitschrift für Kristallographie. Krystallinske materialer, bind 234, udgave 4, sider 277-280, ISSN (online) 2196-7105, ISSN (udskriv) 2194-4946, DOI: doi.org/10.1515/zkri-2018-2145
- National Center for Biotechnology Information. (2019). Klor. PubChem-database. CID = 24526. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Marques Miguel. (s.f.). Klor. Gendannet fra: nautilus.fis.uc.pt
- American Chemistry Council. (2019). Klor kemi: Introduktion til klor. Gendannet fra: chlor.americanchemistry.com
- Fong-Yuan Ma. (S.f.). Ætsende virkninger af klorider på metaller. Institut for Havteknik, NTOU Republikken Kina (Taiwan).
- New York State. (2019). Fakta om klor. Gendannet fra: health.ny.gov
- Dr. Doug Stewart. (2019). Fakta om klorelementer. Chemicool. Gendannet fra: chemicool.com


Endnu ingen kommentarer