
Chlorbenzen (C6H5Cl) Struktur, egenskaber, syntese
Det chlorbenzen er en aromatisk forbindelse med kemisk formel C6H5Cl, specifikt et aromatisk halogenid. Ved stuetemperatur er det en farveløs, brandfarlig væske, der ofte bruges som opløsningsmiddel og affedtningsmiddel. Derudover fungerer det som råmateriale til fremstilling af talrige meget nyttige kemiske forbindelser..
I det sidste århundrede tjente det som grundlag for syntesen af insekticidet DDT, meget nyttigt til udryddelse af sygdomme som malaria. Imidlertid blev brugen i 1970 forbudt på grund af dets høje toksicitet for mennesker. Chlorbenzenmolekylet er polært på grund af en højere elektronegativitet af klor i forhold til det carbonatom, som det binder til.
Dette resulterer i, at chlor har en moderat tæthed af negativ ladning δ- i forhold til carbon og resten af den aromatiske ring. På samme måde er chlorbenzen praktisk talt uopløselig i vand, men det er opløseligt i væsker af aromatisk kemisk art, såsom: chloroform, benzen, acetone osv..
Derudover er Rhodococus phenolicus en bakteriel art, der er i stand til at nedbryde chlorbenzen som den eneste kulstofkilde..
Artikelindeks
- 1 Kemisk struktur
- 2 Kemiske egenskaber
- 2.1 Lugt
- 2.2 Molekylvægt
- 2.3 Kogepunkt
- 2.4 Smeltepunkt
- 2.5 Flammepunkt
- 2.6 Opløselighed i vand
- 2.7 Opløselighed i organiske forbindelser
- 2.8 Tæthed
- 2.9 Dampmassefylde
- 2.10 Damptryk
- 2.11 Selvantænding
- 2.12 Viskositet
- 2.13 Korrosivitet
- 2.14 Forbrændingsvarme
- 2.15 Fordampningsvarme
- 2.16 Overfladespænding
- 2.17 Ioniseringspotentiale
- 2.18 Lugttærskel
- 2.19 Eksperimentelt frysepunkt
- 2.20 Stabilitet
- 3 Syntese
- 4 applikationer
- 4.1 Anvendelser i organisk syntese
- 4.2 Anvendelse til syntese af organiske opløsningsmidler
- 4.3 Medicinske anvendelser
- 5 Referencer
Kemisk struktur
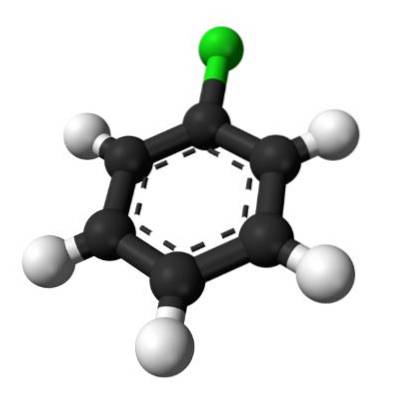
Det øverste billede illustrerer strukturen af chlorbenzen. De sorte kulersfærer udgør den aromatiske ring, mens de hvide sfærer og de grønne sfærer udgør hydrogen- og kloratomer, tilsvarende.
I modsætning til benzenmolekylet har chlorbenzen et dipolmoment. Dette skyldes, at Cl-atomet er mere elektronegativt end resten af de sp hybridiserede carbonatomer.to.
Af denne grund er der ikke en ensartet fordeling af elektrondensitet i ringen, men det meste er rettet mod Cl-atomet..
Ifølge denne forklaring kunne det med et elektrondensitetskort bekræftes, at der, selv om det er svagt, er en region δ-rig på elektroner.
Derfor interagerer chlorbenzenmolekyler med hinanden gennem dipol-dipolkræfter. De er imidlertid ikke stærke nok til, at denne forbindelse eksisterer i den faste fase ved stuetemperatur; af denne grund er det en væske (men med et højere kogepunkt end benzen).
Kemiske egenskaber
Lugt
Dens lugt er mild, ikke ubehagelig og ligner mandel.
Molekylær vægt
112,556 g / mol.
Kogepunkt
131,6 ° C (270 ° F) ved 760 mmHg tryk.
Smeltepunkt
-45,2 ºC (-49 ºF)
Flammepunkt
27 ºC (82 ºF)
Vandopløselighed
499 mg / l ved 25 ºC.
Opløselighed i organiske forbindelser
Det er blandbart med ethanol og ethylether. Det er meget opløseligt i benzen, carbontetrachlorid, chloroform og carbondisulfid.
Massefylde
1,1058 g / cm3 ved 20 ° C (1,11 g / cm3 ved 68 ° F). Det er en væske, der er lidt tættere end vand.
Dampmassefylde
3,88 i forhold til luft. 3,88 (luft = 1).
Damptryk
8,8 mmHg ved 68 ° F; 11,8 mmHg ved 77 ° F; 120 mmHg ved 25 ºC.
Selvantændelse
593 ºC (1.099 ºC)
Viskositet
0,806 mPoise ved 20 ºC.
Ætsende
Angriber nogle typer plast, gummi og nogle typer belægninger.
Forbrændingsvarme
-3.100 kJ / mol ved 25 ºC.
Fordampningsvarme
40,97 kJ / mol ved 25 ºC.
Overfladespænding
33,5 dyn / cm ved 20 ° C.
Ioniseringspotentiale
9,07 eV.
Lugtgrænse
Genkendelse i luft 2.1.10-1 ppm. Lav lugt: 0,98 mg / cm3; høj lugt: 280 mg / cm3.
Eksperimentelt frysepunkt
-45,55 ° C (-50ºF).
Stabilitet
Det er uforeneligt med oxidationsmidler.
Syntese
I industrien anvendes den metode, der blev introduceret i 1851, hvor klorgas (Clto) gennem den flydende benzen ved en temperatur på 240 ºC i nærvær af jernchlorid (FeCl3), der fungerer som en katalysator.
C6H6 => C6H5Cl
Chlorbenzen fremstilles også ud fra anilin i Sandmayer-reaktionen. Anilin danner benzenediazoniumchlorid i nærvær af natriumnitrit; og benzenediazoniumchlorid danner benzenchlorid i nærværelse af kobberchlorid.
Ansøgninger
Anvendelser i organisk syntese
-Det bruges som et opløsningsmiddel, affedtningsmiddel og tjener som et råmateriale til fremstilling af adskillige meget nyttige forbindelser. Chlorbenzen blev brugt til syntesen af insekticidet DDT, der i øjeblikket ikke er i brug på grund af dets toksicitet for mennesker.
-Selvom chlorbenzen i mindre grad anvendes til syntesen af phenol, en forbindelse, der har en fungicid, bakteriedræbende, insekticid, antiseptisk virkning og også anvendes til produktion af landbrugskemikalier såvel som i fremstillingsprocessen for acetisalicylsyre..
-Det er involveret i fremstillingen af diisocyanat, et affedtningsmiddel til bildele.
-Det bruges til at opnå p-nitrochlorbenzen og 2,4-dinitrochlorbenzen.
-Det anvendes til syntesen af forbindelserne triphenylphosphin, thiophenol og phenylsilan.
-Triphenylphosphin anvendes til syntese af organiske forbindelser; thiophenol er et pesticidmiddel og farmaceutisk mellemprodukt. I stedet anvendes phenylsilan i siliconeindustrien.
-Det er en del af råmaterialet til fremstilling af diphenyloxid, der bruges som varmeoverføringsmiddel, til bekæmpelse af plantesygdomme og til fremstilling af andre kemiske produkter..
-P-nitrochlorbenzen opnået fra chlorbenzen er en forbindelse, der anvendes som et mellemprodukt til fremstilling af farvestoffer, pigmenter, lægemidler (paracetamol) og i gummikemi.
Anvendelse til syntese af organiske opløsningsmidler
Chlorbenzen bruges også som råmateriale til fremstilling af opløsningsmidler, der anvendes i syntesereaktioner af organiske forbindelser, såsom methylendiphenyldiisocyanat (MDI) og urethan..
MDI er involveret i syntesen af polyurethan, som opfylder adskillige funktioner i produktionen af byggevarer, køleskabe og frysere, sengemøbler, fodtøj, biler, belægninger og klæbemidler og andre applikationer.
Ligeledes er urethan et råmateriale til produktion af adjuvansforbindelser til landbrug, maling, blæk og rengøringsopløsningsmidler til brug i elektronik..
Medicinske anvendelser
-2,4-dinitrochlorbenzen er blevet brugt i dermatologi til behandling af alopecia areata. Det er også blevet brugt i allergistudier og i immunologien mod dermatitis, vitiligo og i prognosen for udviklingen hos patienter med ondartet melanom, kønsvorter og almindelige vorter..
-Det har været terapeutisk anvendt hos patienter med hiv. På den anden side er det blevet tilskrevet immunmodulatoriske funktioner, et aspekt der er genstand for diskussion..
Referencer
- Dra. Alessandra B. Alió S. (1998). Dinitrochlorbenzen og dets anvendelser. [PDF]. Venezuelansk dermatologi, VOL. 36, nr. 1.
- Panoli Intermediates India Private Limited. Para-nitrochlorbenzen (PNCB). Hentet den 4. juni 2018 fra: panoliindia.com
- Korry Barnes. (2018). Chlorbenzen: Egenskaber, reaktivitet og anvendelser. Hentet den 4. juni 2018 fra: study.com
- Wikipedia. (2018). Chlorbenzen. Hentet den 4. juni 2018 fra: en.wikipedia.org
- PubChem. (2018). Chlorbenzen. Hentet den 4. juni 2018 fra: pubchem.ncbi.nlm.nih.gov


Endnu ingen kommentarer