
Blychloridegenskaber, struktur, anvendelser
Det blyklorid er et uorganisk salt, hvis kemiske formel er PbCln, hvor n er oxidationsantalet af bly. Så når bly er +2 eller +4, er salt PbClto eller PbCl4, henholdsvis. Derfor er der to typer klorider til dette metal.
Af de to er PbClto det er det vigtigste og stabile; mens PbCl4 det er ustabilt og mindre nyttigt. Den første er ionisk i naturen, hvor kationen Pbto+ genererer elektrostatiske interaktioner med Cl-anionen- at bygge et krystalgitter; og den anden er kovalent, med Pb-Cl-bindinger, der stammer fra bly og chlortetraeder.

En anden forskel mellem de to blyklorider er, at PbClto Det er et fast stof af hvide krystaller med form af nåle (øverste billede); mens PbCl4 Det er en gullig olie, der kan krystallisere ved -15 ° C. PbCl inputto det er mere æstetisk end PbCl4.
Ud over hvad der allerede er nævnt, PbClto det findes i naturen som mineralsk cotunite; mens PbCl4 nej, da det er modtageligt for forfald. Skønt fra PbCl4 du kan få PbOto, af PbClto udlede et uendeligt udvalg af organometalliske forbindelser.
Artikelindeks
- 1 egenskaber
- 1,1-bly (II) chlorid
- 1.2 Bly (IV) chlorid
- 2 Struktur
- 2,1-bly (II) chlorid
- 2.2 Molekyle i gasfase
- 3 Nomenklatur
- 4 anvendelser
- 5 Referencer
Ejendomme
Blychloridets egenskaber er i det væsentlige afhængige af blyets oxidationsantal; da klor ikke ændrer sig, men den måde det interagerer med bly på. Derfor skal begge forbindelser behandles separat; bly (II) chlorid på den ene side og bly (IV) chlorid på den anden.
-Bly (II) chlorid
Molar masse
278,10 g / mol.
Fysisk fremtoning
Hvide farvede krystaller med nåleformer.
Massefylde
5,85 g / ml.
Smeltepunkt
501ºC.
Kogepunkt
950ºC.
Vandopløselighed
10,8 g / L ved 20 ° C Det er dårligt opløseligt, og vandet skal opvarmes, så en betydelig mængde kan opløses.
Brydningsindeks
2.199.
Bly (IV) chlorid
Molar masse
349,012 g / mol.
Fysisk fremtoning
Gullig olieagtig væske.
Massefylde
3,2 g / ml.
Smeltepunkt
-15ºC.
Kogepunkt
50 ° C Ved højere temperaturer nedbrydes frigivelse af gasformigt klor:
PbCl4(s) => PbClto(s) + Clto(g)
Faktisk kan denne reaktion blive meget eksplosiv, så PbCl opbevares.4 i svovlsyre ved -80 ° C.
Struktur
-Bly (II) chlorid
Først blev det nævnt, at PbClto er en ionisk forbindelse, så den består af Pb-ionerto+ og Cl- der bygger en krystal, hvori et Pb: Cl-forhold lig med 1: 2 etableres; der er dobbelt så mange Cl-anioner- hvilke kationer Pbto+.
Resultatet er, at der dannes orthorhombiske krystaller, hvis ioner kan repræsenteres med en model af kugler og søjler som i nedenstående billede..

Denne struktur svarer også til strukturen for cotunitmineralet. Selvom stængerne bruges til at indikere en retningsbestemmelse af den ioniske binding, bør den ikke forveksles med en kovalent binding (eller i det mindste rent kovalent).
I disse orthorhombiske krystaller er Pbto+ (grålig kugler) har ni Cl- (grønne kugler), der omgiver ham, som om han var lukket inde i et trekantet prisme. På grund af strukturens indvikling og den lave iondensitet af Pbto+, det er vanskeligt for molekyler at solvatisere krystallen; grunden til, at det er dårligt opløseligt i koldt vand.
Gasfasemolekyle
Når hverken krystallen eller væsken kan modstå de høje temperaturer, begynder ionerne at fordampe som PbCl-molekyler.to diskret; det vil sige med Cl-Pb-Cl kovalente bindinger og en vinkel på 98 °, som om det var en boomerang. Gasfasen siges derefter at bestå af disse PbCl-molekylerto og ingen ioner, der bæres af luftstrømme.
Bly (IV) chlorid
I mellemtiden PbCl4 det er en kovalent forbindelse. Hvorfor? Fordi kationen Pb4+ den er mindre og har også en højere ionisk ladningstæthed end Pbto+, hvilket forårsager en større polarisering af Cl-elektronskyen-. Resultatet er, at i stedet for en ionisk interaktion Pb4+Cl-, Pb-Cl-kovalent binding dannes.
I betragtning af dette er ligheden mellem PbCl4 og for eksempel CCl4; begge forekommer som enkelt tetraedriske molekyler. Således forklares det, hvorfor dette blychlorid er en gullig olie under normale forhold; Cl-atomer er dårligt beslægtede med hinanden og "glider", når to PbCl-molekyler4 de kommer.
Men når temperaturen falder, og molekylerne sænkes, er sandsynligheden og virkningerne af øjeblikkelige dipoler (PbCl4 er apolar givet sin symmetri); og derefter fryser olien som gule sekskantede krystaller:
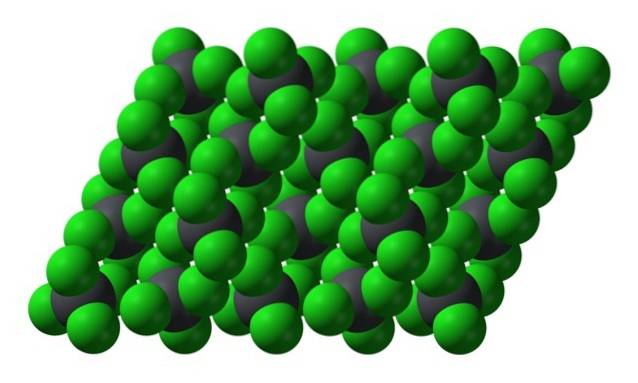
Bemærk, at hver grålig kugle er omgivet af fire grønne kugler. Disse PbCl-molekyler4 "Klemt sammen" udgør en ustabil krystal, der er modtagelig for kraftig nedbrydning.
Nomenklatur
Navnene: bly (II) chlorid og bly (IV) chlorid svarer til dem, der er tildelt i henhold til lagernomenklaturen. Da oxidationstallet +2 er det laveste for bly og +4 det højeste, kan begge klorider navngives i henhold til traditionel nomenklatur som plumbosechlorid (PbClto) og blychlorid (PbCl4), henholdsvis.
Og endelig er der den systematiske nomenklatur, der fremhæver antallet af hvert atom i forbindelsen. PbClto er blydichlorid og PbCl4 bly tetrachlorid.
Ansøgninger
Der er ingen kendt praktisk anvendelse til PbCl4 ud over at tjene til syntesen af PbOto. PbClto Det er mere nyttigt, og det er derfor kun nogle anvendelser til dette specifikke blychlorid vil blive anført nedenfor:
- På grund af sin meget selvlysende natur er den beregnet til fotografiske, akustiske, optiske og strålingsdetektorenheder.
- Da det ikke absorberes i det infrarøde spektrum, bruges det til fremstilling af briller, der transmitterer denne type stråling.
- Det har udgjort en del af det, der kaldes gyldent glas, et attraktivt materiale med iriserende blålig farve, der bruges til dekorative formål..
- Fortsætter også med emnet teknik, når alkaliseret, PbCltoPb (OH)to Det får intense hvidlige toner, der bruges som det hvide blypigment. Imidlertid er dets anvendelse modvirket på grund af dets høje toksicitet..
- Smeltet og blandet med bariumtitanat, BaTiO3, stammer fra det keramiske blybariumtitanat Ba1 - xPbxOnkel3. Hvis en Pbto+ gå ind i BaTiO3, a Bato+ den skal forlade krystallen for at tillade dens inkorporering, og der siges derefter, at en kationudveksling finder sted; deraf sammensætningen af Bato+ udtrykkes som 1-x.
- Og endelig fra PbClto adskillige organometalliske blyforbindelser med den almene formel R syntetiseres4Pb eller R3Pb-PbR3.
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Bly (II) chlorid. Gendannet fra: en.wikipedia.org
- Kemisk formulering. (2019). Bly (IV) chlorid. Gendannet fra: formulacionquimica.com
- Clark Jim. (2015). Kloriderne af kulstof, silicium og bly. Gendannet fra: chemguide.co.uk
- Spektrale og optiske ikke-lineære undersøgelser af blychlorid (PbClto) krystaller. [PDF]. Gendannet fra: shodhganga.inflibnet.ac.in
- National Center for Biotechnology Information. (2019). Blyklorid. PubChem-database; CID = 24459. Gendannet fra: pubchem.ncbi.nlm.nih.gov



Endnu ingen kommentarer