
Ferrochlorid (FeCl2) struktur, anvendelser, egenskaber

Det jernchlorid er et uorganisk fast stof dannet ved foreningen af en Fe-kationto+ og to chloranioner Cl-. Dens kemiske formel er FeClto. Det har en tendens til at absorbere vand fra miljøet. Et af dets hydrater er FeCl tetrahydratto•4HtoEller som er et grønligt fast stof.
Det skal bemærkes, at det er meget opløseligt i vand og har en tendens til let at oxideres i nærvær af luft og danner jernchlorid FeCl.3. Fordi det let oxideres og derfor kan fungere som et reduktionsmiddel, bruges det i vid udstrækning i kemiske og biologiske forskningslaboratorier..

Jernklorid har flere anvendelser, hvoraf det vigtigste er at hjælpe andre stoffer i oxidationen af slam fra spildevand eller spildevandsrensning. Det bruges også i jernbelægningsprocessen af metaller og har nogle anvendelser i den farmaceutiske industri..
Brugen af FeCl er også blevet eksperimenteretto i genvinding af værdifulde metaller fra brugte katalysatorer, der findes i udstødningsrørene i køretøjer, der kører på benzin eller diesel.
Det bruges i tekstilindustrien til at fastgøre farverne i nogle stoftyper.
Artikelindeks
- 1 Struktur
- 2 Nomenklatur
- 3 egenskaber
- 3.1 Fysisk tilstand
- 3.2 Molekylvægt
- 3.3 Smeltepunkt
- 3.4 Kogepunkt
- 3.5 Specifik vægt
- 3.6 Opløselighed
- 3.7 Andre egenskaber
- 4 Opnåelse
- 5 anvendelser
- 5.1 Ved farvning af stoffer
- 5.2 I spildevandsrensning
- 5.3 I kemiske studier
- 5.4 I biokemiske studier
- 6 Referencer
Struktur
Jernchlorid består af en jernholdig ion Feto+ og to chlorioner Cl- forbundet med ioniske bindinger.
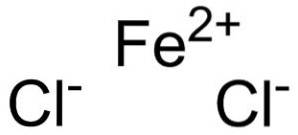
Ferro-ion Feto+ har følgende elektroniske struktur:
1sto, 2sto 2 s6, 3sto 3p6 3d6, 4s0
hvor det kan ses, at han mistede to elektroner fra 4s skallen.
Denne konfiguration er ikke særlig stabil, og af denne grund har den en tendens til at oxidere, det vil sige at miste en anden elektron, denne gang fra det 3d lag, der danner Fe ion.3+.
For sin del er chloridionen Cl- har følgende elektroniske struktur:
1sto, 2sto 2 s6, 3sto 3p6
hvor du kan se, at den erhvervede en ekstra elektron i 3p-skalen og fuldførte den. Denne konfiguration er meget stabil, fordi alle de elektroniske lag er komplette.
Nomenklatur
- Jernklorid
- Jern (II) chlorid
- Jerndichlorid
- Jernchlorid tetrahydrat: FeClto•4HtoELLER
Ejendomme
Fysisk tilstand
Farveløs til lysegrøn fast, krystaller.
Molekylær vægt
126,75 g / mol
Smeltepunkt
674 ºC
Kogepunkt
1023 ºC
Specifik vægt
3.16 ved 25 ºC / 4 ºC
Opløselighed
Meget opløselig i vand: 62,5 g / 100 ml ved 20 ºC. Opløselig i alkohol, acetone. Let opløselig i benzen. Næsten uopløselig i ether.
Andre egenskaber
FeClto vandfri er meget hygroskopisk. Det absorberer let vand fra miljøet og danner en række hydrater, især tetrahydratet, hvori for hvert FeCl-molekyleto der er 4 molekyler af HtoEller knyttet til dette (FeClto•4HtoELLER).
I nærvær af luft oxiderer den langsomt til FeCl3. Dette betyder, at Fe ionto+ let oxideret til Fe ion3+.
Hvis det opvarmes i nærværelse af luft, dannes der hurtigt jernchlorid FeCl3 og jernoxid FetoELLER3.
FeClto det er ætsende for metaller og stoffer.
Opnåelse
Det opnås ved behandling af et overskud af jernmetal Fe med en vandig opløsning af saltsyre-HCl ved høje temperaturer..
Tro0 + 2 HCI → FeClto + 2 timer+
På grund af tilstedeværelsen af vand ved denne fremgangsmåde opnås imidlertid jernchloridtetrahydrat FeCl.to•4HtoELLER.
For at opnå det vandfrit (uden vand inkorporeret i krystallerne) har nogle forskere valgt at udføre reaktionen af jernpulver med vandfri HCI (uden vand) i opløsningsmidlet tetrahydrofuran (THF) ved en temperatur på 5 ºC..
Forbindelsen FeCl opnås på denne mådeto•1,5 THF, som ved opvarmning til 80-85 ºC under vakuum eller i en nitrogenatmosfære (for at undgå tilstedeværelse af vand) producerer FeClto vandfri.
Ansøgninger
Jernklorid har forskellige anvendelser, generelt baseret på dets reducerende kapacitet, dvs. det kan let oxideres. Det bruges for eksempel i maling og belægning, da det hjælper med at fastgøre dem til overfladen.
Jern er et vigtigt mikronæringsstof for menneskers og visse dyrs sundhed. Det er involveret i syntesen af proteiner, i respiration og i multiplikation af celler.
Derfor FeClto det bruges i farmaceutiske præparater. Fe ionto+ som sådan absorberes det bedre end Fe ion3+ i tarmen.
Det bruges til fremstilling af FeCl3. Det bruges i metallurgi, i jernbelægningsbade for at give en mere duktil aflejring.
Her er andre anvendte anvendelser.
I farvning af stoffer
FeClto Det bruges som et mordant eller farvestof fixativ i nogle typer stof. Mordanten reagerer kemisk og binder sig samtidigt til farvestoffet og stoffet og danner en uopløselig forbindelse på det..
På denne måde forbliver farvestoffet fast på stoffet, og dets farve intensiveres..
I spildevandsrensning
FeClto anvendes i kloak- eller spildevandsrensningsanlæg (spildevand).
I denne ansøgning deltager jernchlorid i oxidationen af slammet gennem en proces kaldet Fenton-oxidation. Denne oxidation forårsager nedbrydning af mudderflockerne og tillader frigivelse af det vand, der er stærkt bundet til det..

Slammet kan derefter tørres og bortskaffes på en miljøvenlig måde. Anvendelsen af jernchlorid hjælper med at reducere omkostningerne ved processen.
Det er også for nylig blevet foreslået at bruge det til at reducere dannelsen af hydrogensulfid eller hydrogensulfid i disse spildevand..
På denne måde ville den korrosion, der produceres af denne gas, og også ubehagelige lugte blive reduceret..
I kemiske studier
På grund af dets reducerende egenskaber (det modsatte af oxidant), FeClto Det er meget brugt i forskellige undersøgelser i kemi, fysik og ingeniørlaboratorier.
Visse forskere brugte jernchloriddampe til at ekstrahere værdifulde metaller som platin, palladium og rhodium fra brugte katalysatorer i benzin- eller dieseldrevne køretøjer..
Disse katalysatorer bruges til at fjerne gasser, der er skadelige for mennesker og miljø. De er placeret i udstødningsrøret på biler og lastbiler, der kører på benzin eller diesel.

Efter en vis tid slides køretøjets katalysator og mister sin effektivitet og skal udskiftes. Den brugte katalysator kasseres, og der er bestræbelser på at genvinde de værdifulde metaller, den indeholder..

Ifølge forskerne dannede disse metaller magnetiske legeringer med jernet i jernchlorid..
Legeringerne kunne ekstraheres med magneter og derefter genvindes de værdifulde metaller ved hjælp af velkendte metoder..
I biokemiske studier
For at have Fe kationento+, som er et vigtigt mikronæringsstof hos mennesker og nogle dyr, FeClto anvendt i biokemi og medicinstudier.
Visse undersøgelser har vist, at jernchlorid forbedrer fungicid virkning af koldt argonplasma..
Koldt plasma er en teknologi, der anvendes til sterilisering af medicinske overflader og instrumenter. Det er baseret på dannelsen af hydroxylradikaler OH · fra miljøets fugtighed. Disse radikaler reagerer med cellevæggen i mikroorganismen og forårsager dens død.
I denne undersøgelse FeClto forbedrede effekten af koldt plasma og fremskyndede eliminering af en svamp, der er resistent over for andre desinfektionsmetoder.
Nogle forskere fandt ud af, at brugen af FeClto gør det muligt at øge udbyttet i reaktionerne for at opnå glucose startende fra sukkerrør bagasse.
I dette tilfælde er det Feto+ et væsentligt mikroelement for menneskers sundhed, dets tilstedeværelse i spor i produktet påvirker ikke mennesker.
Referencer
- Fukuda, S. et al. (2019). Jernholdigt klorid og jernholdigt sulfat forbedrer den fungicide virkning af koldt atmosfærisk argonplasma på melaniseret Aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. Gendannet fra ncbi.clm.nih.gov.
- Ismal, O.E. og Yildirim, L. (2019). Metalmordants og biomordants. I virkningen og udsigterne for grøn kemi til tekstilteknologi. Kapitel 3, s. 57-82. Gendannet fra sciencedirect.com.
- Zhang, W. et al. (2019). Co-katalyse af magnesiumchlorid og jernholdigt chlorid til xylo-oligosaccharider og glukoseproduktion fra sukkerrør bagasse. Bioresour Technol 2019, 291: 121839. Gendannet fra ncbi.nlm.nih.gov.
- Zhou, X. et al. (2015). Indfødt jerns rolle til forbedring af slamafvandbarhed gennem peroxidering. Videnskabelige rapporter 5: 7516. Gendannet fra ncbi.nlm.nih.gov.
- Rathnayake, D. et al. (2019). Hydrogensulfidkontrol i kloakker ved at katalysere reaktionen med ilt. Videnskab om det samlede miljø 689 (2019) 1192-1200. Gendannet fra ncbi.nlm.nih.gov.
- Taninouchi, Y. og Okabe, T.H. (2018). Gendannelse af platinagruppemetaller fra brugte katalysatorer ved brug af jernchloriddampbehandling. Metall og Materi Trans B (2018) 49: 1781. Gendannet fra link.springer.com.
- OS. National Library of Medicine. (2019). Jernklorid. Gendannet fra: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. et al. (1977). Jern (0) Oxidation med hydrogenchlorid i tetrahydrofuran: en enkel måde at vandfrit jern (II) chlorid på. Inorganic Chemistry, bind 16, nr. 7, 1977. Gendannet fra pubs.acs.org.
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.


Endnu ingen kommentarer