
Ammoniumhydroxidstruktur, egenskaber og anvendelser
Det ammoniumhydroxid er en forbindelse med molekylformlen NH4Åh åh5NO produceret ved opløsning af ammoniakgas (NH3) i vand. Af denne grund kaldes det ammoniakvand eller flydende ammoniak..
Det er en farveløs væske med en meget intens og skarp lugt, som ikke kan isoleres. Disse egenskaber har et direkte forhold til koncentrationen af NH3 opløst i vand koncentration, der faktisk, da det er en gas, kan omfatte enorme mængder af det opløst i et lille volumen vand.
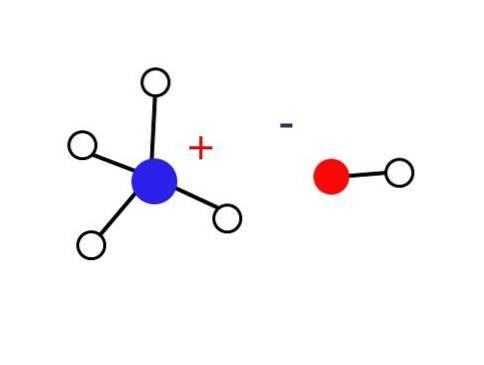
En betydelig lille del af disse vandige opløsninger består af NH-kationer.4+ og OH-anionerne-. På den anden side kan ammoniak findes i form af hydrater, såsom: NH i meget fortyndede opløsninger eller i frosne faste stoffer ved meget lave temperaturer.3∙ HtoEller 2NH3∙ HtoO og NH3∙ 2HtoELLER.
Som en underlig kendsgerning består Jupiters skyer af fortyndede opløsninger af ammoniumhydroxid. Imidlertid kunne Galileo-rumsonde ikke finde vand i planetens skyer, hvilket kunne forventes på grund af den viden, vi har om dannelsen af ammoniumhydroxid; det vil sige, de er NH-krystaller4OH helt vandfri.
Ammoniumionen (NH4+) produceres i det renale rørformede lumen ved forening af ammoniak og hydrogen, udskilt af de nyre rørformede celler. Ligeledes produceres ammoniak i nyrerørceller i processen med transformation af glutamin til glutamat og til gengæld i omdannelsen af glutamat til α-ketoglutarat.
Ammoniak produceres industrielt ved Haber-Bosch-metoden, hvor nitrogen og brintgasser reageres; ved anvendelse af jern-ion, aluminiumoxid og kaliumoxid som katalysatorer. Reaktionen udføres ved høje tryk (150 - 300 atmosfærer) og høje temperaturer (400-500 ºC) med et udbytte på 10-20%.
Ammoniak produceres i reaktionen, som når oxiderer producerer nitrit og nitrat. Disse er væsentlige til opnåelse af salpetersyre og gødning, såsom ammoniumnitrat..
Artikelindeks
- 1 Kemisk struktur
- 1.1 Ammoniakis
- 2 Fysiske og kemiske egenskaber
- 2.1 Molekylær formel
- 2.2 Molekylvægt
- 2.3 Udseende
- 2.4 Koncentration
- 2,5 Lugt
- 2.6 Smag
- 2.7 Tærskelværdi
- 2.8 Kogepunkt
- 2.9 Opløselighed
- 2.10 Opløselighed i vand
- 2.11 Tæthed
- 2.12 Dampmassefylde
- 2.13 Damptryk
- 2.14 Ætsende handling
- 2,15 pH
- 2.16 Dissociationskonstant
- 3 Nomenklatur
- 4 Opløselighed
- 5 risici
- 5.1 Reaktivitet
- 6 anvendelser
- 6.1 I mad
- 6.2 Terapeutiske midler
- 6.3 Industriel og diverse
- 6.4 I landbruget
- 7 Referencer
Kemisk struktur
Som definitionen indikerer, består ammoniumhydroxid af en vandig opløsning af ammoniakgas. Derfor er der inden i væsken ingen anden defineret struktur end den for et tilfældigt arrangement af NH-ioner.4+ og OH- solvatiseret af vandmolekyler.
Ammonium- og hydroxylioner er produkter med en ligevægt af ammoniakhydrolyse, så det er almindeligt, at disse opløsninger har en skarp lugt:
NH3(g) + HtoO (l) <=> NH4+(ac) + OH-(ac)
I henhold til den kemiske ligning ville et højt fald i vandkoncentrationen flytte ligevægten til dannelsen af mere ammoniak; når ammoniumhydroxidet opvarmes, frigøres ammoniakdampe.
Af denne grund NH-ioner4+ og OH- undlader at danne en krystal under jordiske forhold, hvilket resulterer i den faste base NH4Åh eksisterer ikke.
Nævnte faste stof skal kun være sammensat af elektrostatisk interagerende ioner (som vist på billedet).
Ammoniakis
Imidlertid under temperaturer langt under 0 ° C og omgivet af enorme tryk som dem, der hersker i kernerne af iskolde måner, fryser ammoniak og vand. Dermed krystalliserer de sig til en fast blanding med forskellige støkiometriske forhold, hvor den enkleste er NH3∙ HtoO: ammoniakmonohydrat.
NH3∙ HtoO og NH3∙ 2HtoEller de er ammoniakis, da det faste stof består af et krystallinsk arrangement af vand- og ammoniakmolekyler forbundet med hydrogenbindinger..
I betragtning af en ændring i T og P, ifølge beregningsundersøgelser, der simulerer alle fysiske variabler og deres virkninger på disse is, sker der en overgang af en NH-fase.3∙ nHtoEller til en NH-fase4Åh.
Derfor er det kun under disse ekstreme forhold, at NH4OH kan eksistere som et produkt af en protonering i is mellem NH3 og HtoELLER:
NH3(s) + HtoDu) <=> NH4Åh s)
Bemærk at denne gang i modsætning til ammoniakhydrolyse er de involverede arter i en fast fase. En ammoniakis, der bliver salt uden frigivelse af ammoniak.
Fysiske og kemiske egenskaber
Molekylær formel
NH4Åh åh5IKKE
Molekylær vægt
35,046 g / mol
Udseende
Det er en farveløs væske.
Koncentration
Op til ca. 30% (for NH-ioner4+ og OH-).
Lugt
Meget stærk og skarp.
Smag
Hektar.
Tærskelværdi
34 ppm til ikke-specifik detektion.
Kogepunkt
38 ºC (25%).
Opløselighed
Findes kun i vandig opløsning.
Vandopløselighed
Blandbar i ubegrænsede proportioner.
Massefylde
0,90 g / cm3 ved 25 ºC.
Dampmassefylde
I forhold til luft taget som enhed: 0,6. Det vil sige, det er mindre tæt end luft. Logisk set refererer den rapporterede værdi imidlertid til ammoniak som en gas, ikke dens vandige opløsninger eller NH4Åh.
Damptryk
2.160 mmHg ved 25 ºC.
Ætsende handling
Det er i stand til at opløse zink og kobber.
pH
11,6 (1N opløsning); 11,1 (opløsning 0,1 N) og 10,6 (0,01 N opløsning).
Dissociation konstant
pKb = 4,767; Kb = 1,71 x 10-5 ved 20 ºC
pKb = 4,751; Kb = 1.774 x 10-5 ved 25 ° C.
Forøgelse af temperaturen øger næsten umærkeligt ammoniumhydroxids basalitet.
Nomenklatur
Hvad er alle de almindelige og officielle navne, som NH modtager?4OH? I henhold til hvad der er etableret af IUPAC, er navnet ammoniumhydroxid, fordi det indeholder hydroxylanionen.
Ammonium er på grund af dets +1-ladning monovalent, så ved hjælp af stamnomenklaturen navngives det som: ammoniumhydroxid (I).
Selvom brugen af udtrykket ammoniumhydroxid er teknisk forkert, da forbindelsen ikke kan isoleres (i det mindste ikke på jorden, som forklaret detaljeret i første afsnit).
Også kaldes ammoniumhydroxid ammoniakvand og flydende ammoniak..
Opløselighed
NH4OH eksisterer ikke som et salt under jordbundsforhold, det kan ikke estimeres, hvor opløselig det er i forskellige opløsningsmidler.
Det forventes imidlertid at være ekstremt opløseligt i vand, da dets opløsning vil frigive enorme mængder NH3. Teoretisk set ville det være en fantastisk måde at opbevare og transportere ammoniak på.
I andre opløsningsmidler, der er i stand til at acceptere hydrogenbindinger, såsom alkoholer og aminer, kunne det forventes, at det også ville være meget opløseligt i dem. Her NH-kationen4+ er en hydrogenbindingsdonor og OH- fungerer som begge dele.
Eksempler på disse interaktioner med methanol vil være: H3N+-H - OHCH3 og HO- - HOCH3 (OHCH3 angiver, at ilt modtager hydrogenbindingen, ikke at methylgruppen er bundet til H).
Risici
-Ved kontakt med øjnene forårsager det irritation, som kan føre til øjenskader..
-Det er ætsende. Derfor kan det ved hudkontakt forårsage irritation og ved høje koncentrationer af reagenset forårsager det forbrændinger af huden. Gentagen kontakt af ammoniumhydroxid med huden kan få det til at være tørt, kløende og rødt (dermatitis)..
-Indånding af ammoniumhydroxid-tåge kan forårsage akut irritation i luftvejene, der er kendetegnet ved kvælning, hoste eller åndenød. Langvarig eller gentagen eksponering for stoffet kan resultere i tilbagevendende bronchiale infektioner. Også indånding af ammoniumhydroxid kan forårsage irritation i lungerne..
-Eksponering for høje koncentrationer af ammoniumhydroxid kan udgøre en medicinsk nødsituation, da væskeophobning i lungerne (lungeødem) kan forekomme..
-Koncentrationen på 25 ppm er taget som en eksponeringsgrænse i et 8-timers arbejdsskift i et miljø, hvor arbejdstageren udsættes for den skadelige virkning af ammoniumhydroxid.
Reaktivitet
-Ud over den potentielle sundhedsskade ved udsættelse for ammoniumhydroxid er der andre forholdsregler, der skal tages i betragtning, når der arbejdes med stoffet..
-Ammoniumhydroxid kan reagere med mange metaller, såsom: sølv, kobber, bly og zink. Det reagerer også med saltene af disse metaller for at danne eksplosive forbindelser og frigive brintgas; hvilket igen er brandfarligt og eksplosivt.
-Det kan reagere voldsomt med stærke syrer, for eksempel: saltsyre, svovlsyre og salpetersyre. Det reagerer også på samme måde med dimethylsulfat og halogener..
-Reagerer med stærke baser, såsom natriumhydroxid og kaliumhydroxid, der producerer ammoniakgas. Dette kan verificeres ved at observere ligevægten i opløsning, hvor tilsætningen af OH-ioner- skifter ligevægt til NH-dannelse3.
-Kobber- og aluminiummetaller såvel som andre galvaniserede metaller bør ikke anvendes ved håndtering af ammoniumhydroxid på grund af dets ætsende virkning på dem..
Ansøgninger
I mad
-Det bruges som tilsætningsstof i mange fødevarer, hvor det fungerer som et hævemiddel, pH-kontrol og efterbehandlingsmiddel til overfladen af fødevarer..
-Listen over fødevarer, hvor ammoniumhydroxid anvendes, er omfattende og inkluderer bagværk, oste, chokolade, slik og budding..
-Ammoniumhydroxid er opført som et sikkert stof af FDA til fødevareforarbejdning, så længe etablerede standarder følges..
-I kødprodukter bruges det som et antimikrobielt middel, der er i stand til at eliminere bakterier som E. coli og reducere det til ikke-detekterbare niveauer. Bakterierne findes i tarmene hos kvæg og tilpasser sig det sure miljø. Ammoniumhydroxid hindrer bakterievækst ved at regulere pH-værdien.
Terapeutik
-Ammoniumhydroxid har flere terapeutiske anvendelser, herunder:
-10% -opløsningen bruges som et stimulerende middel til åndedrætsrefleksen
-Eksternt bruges det på huden til behandling af insektbid og bid - Det virker i fordøjelsessystemet som et antacida og carminativt middel, det vil sige, det hjælper med at fjerne gasser.
Derudover bruges det som et aktuelt rubefacient mod akutte og kroniske smerter i bevægeapparatet. Som en konsekvens af ammoniumhydroxids rubefaciente virkning er der en lokal stigning i blodgennemstrømning, rødme og irritation..
Industriel og diverse
-Det virker til at reducere NOx (stærkt reaktive gasser såsom nitrogenoxid (NO) og nitrogendioxid (NOto)) til batterimissioner og NOx-reduktion i stackemissioner.
-Det bruges som blødgøringsmiddel; malingstilsætningsstof og til overfladebehandling.
-Øger hårets porøsitet, så farvestoffets pigmenter får en større gennemtrængning, hvilket opnår en bedre finish.
-Ammoniumhydroxid anvendes som et antimikrobielt middel til spildevandsbehandling. Derudover er det involveret i syntesen af chloramin. Dette stof opfylder en funktion, der svarer til klor ved oprensning af poolvand, og har den fordel, at det er mindre giftigt.
-Det bruges som en korrosionsinhibitor i olieraffineringsprocessen.
-Det bruges som rengøringsmiddel i forskellige industrielle og kommercielle produkter og bruges på forskellige overflader, herunder: rustfrit stål, porcelæn, glas og ovn.
-Derudover bruges det til produktion af vaskemidler, sæber, lægemidler og blæk..
I landbruget
Selvom det ikke administreres direkte som gødning, udfører ammoniumhydroxid denne funktion. Ammoniak produceres af atmosfærisk kvælstof efter Haber-Bosch-metoden og transporteres nedkølet under kogepunktet (-33 ºC) til dets anvendelsessteder.
Den ammoniak, der er under tryk, injiceres som damp i jorden, hvor den straks reagerer med det edafiske vand og passerer i form af ammonium (NH4+), som bevares i jordens kationudvekslingssteder. Derudover produceres ammoniumhydroxid. Disse forbindelser er en kilde til nitrogen.
Sammen med fosfor og kalium udgør kvælstof triaden af de vigtigste næringsstoffer, der er vigtige for deres vækst..
Referencer
- Ganong, W. F. (2002). Medicinsk fysiologi. 19. udgave. Moderne manuel redaktionel.
- A. D. Fortes, J. P. Brodholt, I. G. Wood og L. Vocadlo. (2001). Ab initio simulering af ammoniakmonohydrat (NH3∙ HtoO) og ammoniumhydroxid (NH4OH). American Institute of Physics. J. Chem. Phys., Bind 115, nr. 15, 15.
- Helmenstine, Anne Marie, Ph.D. (6. februar 2017). Fakta om ammoniumhydroxid. Gendannet fra: thoughtco.com
- Pochteca Group. (2015). Ammoniumhydroxid. pochteca.com.mx
- NJ Health. (s.f.). Farligt stof Faktaark: ammoniumhydroxid. [PDF]. Gendannet fra: nj.gov
- Kemielærer. (2018). Ammoniumhydroxid. Gendannet fra: chemistrylearner.com
- PubChem. (2018). Ammoniumhydroxid. Gendannet fra: pubchem.ncbi.nlm.nih.gov



Endnu ingen kommentarer