
Fordelingskoefficient for distribution, distribution, applikationer
Det fordelingskoefficient eller fordeling Det defineres som forholdet mellem koncentrationen af en kemisk art eller opløst stof mellem to medier i ligevægt. Dette medium kan være en gaslignende luft; en væske såsom vand eller olie; eller en kompleks blanding, såsom blod eller andet væv.
Fordelingskoefficienten for blod / luft er vigtig for at forklare den gasudveksling, der forekommer i lungerne mellem blodet og atmosfæren..
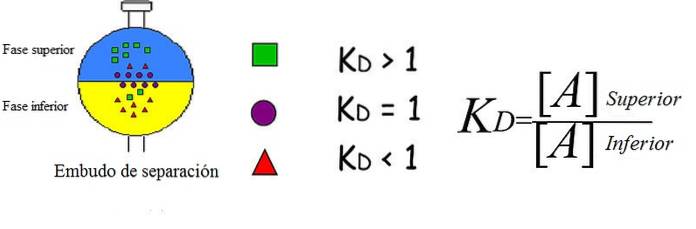
Ovenstående billede demonstrerer på en forenklet og genial måde konceptet forklaret. Hver figur repræsenterer en analyt, som er fordelt og / eller fordelt mellem to ublandbare faser: den ene overlegen og den anden ringere..
De grønne firkanter er overvejende i den øverste fase; mens de røde trekanter opløses mere i den nedre fase, og de lilla cirkler vælger at være ved grænsefladen.
Du kan se, hvordan K variererD for hver analyt. Hvis KD er større end 1, fordeles analytten mere mod den øvre fase; hvis dens værdi er tæt på 1, vil den have tendens til at være placeret på grænsefladen; eller hvis tværtimod KD er mindre end 1, vil det hovedsagelig være i den nedre fase.
En af formerne for fordelingskoefficient er den mellem to ublandbare væsker i ligevægt; ligesom n-oktansystemet og vandet. Dette system er blevet brugt til at etablere en vigtig egenskab ved en forbindelse: dens hydrofobe eller hydrofile karakter..
Værdien af fordelingskoefficienten (P) eller fordelingskoefficienten (K) tjener til at indikere hydrofobiciteten af et lægemiddel. Således kan den bruges til at forudsige dens tarmabsorption, distribution, metabolisme og udskillelsesproces..
Artikelindeks
- 1 Fordelingskoefficient
- 1.1 Definition
- 1.2 Fortolkning
- 1.3 Fordelingskoefficient for oktanol / vand
- 1.4 Begrænsninger
- 2 Fordelingskoefficient (D)
- 3 Eksperimentel bestemmelse af en fordelingskoefficient
- 3.1 Rystekolbe-metoden
- 3.2 Højtydende væskekromatografimetode
- 4 applikationer
- 4.1 Optimering af lægemiddelhandling
- 4.2 Landbrugskemikalier
- 4.3 Omsorg for miljøet
- 5 Referencer
Fordelingskoefficient
Definition
Fordelingskoefficienten (K) for et stof, også kaldet fordelingskoefficienten (P), er kvotienten for at dele koncentrationerne af et stof i to faser; består af blandingen af to opløsningsmidler, der er ublandbare på grund af deres forskellige densiteter og natur.
Værdien af fordelingskoefficienten (K) eller fordelingen (P) er relateret til forskellen i stoffets opløselighed i de ublandbare væsker, der er en del af blandingen.
K eller P = [stof]1 / [stof]to
[stof]1 er koncentrationen af stoffet i væske 1. Y [stof]to er koncentrationen af det samme stof i væske 2.
Fortolkning
Hvis K eller P har en værdi lig med 3, indikerer det, at stoffet er 3 gange mere koncentreret i væske 1 end i væske 2. Men på samme tid indikerer det også, at stoffet er mere opløseligt i væske 1.
Hvis værdien af K eller P nu er 0,3, har stoffet en højere koncentration i væske 2; og derfor er dets opløselighed større i væske 2 end i væske 1.
Fordelingskoefficient for oktanol / vand
I nogle forskningsområder, såsom organisk kemi og farmaceutiske stoffer, består blandingen af væsker af vand og en apolær væske såsom n-octanol eller 1-octanol, hvorfor der ofte henvises til octanol-fordelingskoefficienten. / Vand repræsenteret af Pow.
N-octanol har en densitet på 0,824 g / cm33; mens vand, som det er kendt, har en densitet på 1 g / cm3 nogenlunde konstant. Når de to væsker er afbalanceret, optager n-octanol den øverste del af blandingen af de ublandbare væsker, der er blevet kaldt væsken 1.
Et hydrofobt stof vil have en højere koncentration i n-octanol, når de ublandbare væsker er ækvilibreret. På den anden side vil et hydrofilt stof have en højere koncentration i vand..
Begrænsninger
Fordeling eller distributionskoefficient gælder for ikke-ioniserede stoffer. I det tilfælde, hvor fordelingskoefficienten måles i et ioniserbart stof, skal pH-værdien justeres, eller der anvendes en buffer i den vandige fase for at sikre, at stoffet fremstår som ikke-adskilt.
Ved bestemmelse af fordelingskoefficienten bør overfladeaktive stoffer eller overfladeaktive stoffer ikke anvendes, da disse stoffer på grund af deres amfifile natur er placeret ved grænsefladen mellem ublandbare væsker..
Fordelingskoefficienten n-octanol / vand udtrykkes normalt i logaritmisk form; det vil sige som log P eller log K på grund af amplituden af værdierne for P og K.
Hvis loggen af P for et stof er større end 0, er det tegn på, at stoffet er hydrofobt. Tværtimod, hvis loggen af P er mindre end 0 (dvs. negativ), vil dette indikere at stoffet er hydrofilt..
Fordelingskoefficient (D)
Fordelingskoefficienten (D) er kvotienten mellem koncentrationen af alle stoffer, ioniseret og ikke-ioniseret, i væske 1 (n-octanol) og koncentrationen af de samme stoffer i væske 2 (vand).
Når først værdien af distributionskoefficienten (D) er opnået, kan den udtrykkes som en logaritme af D på grund af amplituden af værdierne for D.
For at opnå distributionskoefficienten (D) skal den vandige fase være bufret; det vil sige ved en bestemt pH-værdi, som skal angives, når der henvises til værdien af den opnåede distributionskoefficient.
Det er praktisk at udføre bestemmelsen af D ved pH 7,4. Denne pH svarer til blodets og repræsenterer de betingelser, som lægemidler eller forbindelser vil støde på i det intracellulære miljø og i det ekstracellulære miljø..
For en ikke-ioniserbar forbindelse log D = log P, uanset pH anvendt.
Eksperimentel bestemmelse af en fordelingskoefficient
Der er flere metoder til måling af fordelingskoefficient (P). Disse inkluderer rystekolbe-metoden og højtydende væskekromatografi. Begge kræver forudgående viden om teststoffets opløselighed, både i n-octanol og i vand..
Ryst kolbe-metoden
Prøven opløses i n-octanol mættet med vand, som opdeles i en separerende eller dekanterende tragt med vand mættet med n-octanol. Mætning af opløsningsmidler er nødvendig for at undgå overførsel af opløsningsmiddel under opdelingsprocessen.
Skiltetragten udsættes for mekanisk omrøring i et bestemt tidsrum. Det lades derefter stå i lang tid for at sikre fuldstændig adskillelse. Afslutningsvis er faserne adskilt ved dekantering.
Derefter bestemmes koncentrationen af prøven i hvert af opløsningsmidlerne ved hjælp af en spektrofotometrisk metode; f.eks. UV-synlig eller anden metode. Endelig beregnes delingskoefficienten og log P med de opnåede data..
Denne metode har fordelen af at være billig, reproducerbar og med høj præcision. Sammenfattende er det den mest pålidelige metode til bestemmelse af log P.
Den største ulempe ved metoden er, at den er meget tidskrævende: mere end 24 timer til at udføre væskeækvilibrering, omrøring og faseseparation under partitioneringsprocessen. Desuden gælder den kun for stoffer, der er opløselige i n-octanol og vand..
Højtydende væskekromatografimetode
Log P kan opnås ved at korrelere prøvens retentionstid med retentionstiden for en referenceforbindelse med lignende kemisk struktur med en kendt P-værdi..
Det er en metode, hvor log P-værdien opnås i en tid på mindre end 20 minutter. Det giver log p-værdier mellem 0 og 6, som kun svarer til hydrofobe stoffer.
Ulempen er, at P-værdien bestemmes ved lineær regression, så flere forbindelser med en kemisk struktur svarende til prøven og kendte log P-værdier skal bruges som reference..
Ansøgninger
Optimering af lægemiddelhandling
Hvis et lægemiddel indtages, skal det nå tyndtarmen, hvor de fleste stoffer absorberes. Derefter går det gennem det indre af cellerne og opløses i lipid-dobbeltlaget, der er en del af membranen. Denne proces foretrækkes af lægemidlets hydrofobe natur..
Lægemidlet skal passere gennem tarmceller, krydse basalmembranen for at nå blodet og nå målreceptorerne for lægemiddelhandling. Nogle faser af den samlede proces favoriseres af lægemidlets hydrofobe natur, men andre er det ikke..
Der skal findes en værdi af fordelingskoefficienten, der gør det muligt for alle de processer, der er nødvendige for lægemidlets virkning og kroppens velbefindende, at være tilfredsstillende.
Anvendelsen af overdrevent hydrofobe lægemidler kan være giftig, da deres stofskifte kan producere potentielt skadelige metabolitter. På den anden side udgør totalt hydrofile lægemidler vanskeligheder for intestinal absorption..
Landbrugskemikalier
Aktiviteten af insekticider og herbicider er påvirket af deres hydrofobe natur. Imidlertid er hydrofobicitet forbundet med en længere halveringstid. Derfor er den forurenende virkning på miljøet langvarig og kan forårsage økologisk skade..
Effektive hydrofobe produkter skal produceres med en kortere halveringstid.
Miljøpleje
Hydrofobe forbindelser er normalt forurenende for miljøet, da de drænes gennem jorden og kan nå grundvand og senere flodvand.
Kendskab til en forbindelses fordelingskoefficient, kan der foretages ændringer i dens kemiske struktur, der ændrer dens hydrofobicitet for at reducere dens forurenende virkning på miljøet..
Hydrogeologi bruger oktanol / vand-fordelingskoefficienten (Kow) til at kontrollere strømmen af hydrofobe forbindelser, både i jord og i grundvand.
Referencer
- Bannan, C. C., Calabró, G., Kyu, D. Y., & Mobley, D. L. (2016). Beregning af fordelingskoefficienter for små molekyler i octanol / vand og cyclohexan / vand. Tidsskrift for kemisk teori og beregning, 12(8), 4015-4024. doi: 10.1021 / acs.jctc.6b00449
- Wikipedia. (2019). Fordelingskoefficient. Gendannet fra: es.wikipedia.org
- Nationalt universitet i Colombia. (s.f.). Enhed 8: Eksperimentel bestemmelse af barbituratfordelingskoefficienten. [PDF]. Gendannet fra: red.unal.edu.co
- Sevier. (2019). Fordelingskoefficient. Science Direct. Gendannet fra: sciencedirect.com
- Seeboo Hemnath. (2019). Fordelingskoefficient: Definition og beregning. Undersøgelse. Gendannet fra: study.com


Endnu ingen kommentarer