
Halogenerede derivategenskaber, anvendelser og eksempler

Det halogenerede derivater er alle de forbindelser, der har et halogenatom; dvs. ethvert af elementerne i gruppe 17 (F, Cl, Br, I). Disse elementer adskiller sig fra resten ved at være mere elektronegative og danne en mangfoldighed af uorganiske og organiske halogenider..
Billedet nedenfor viser de gasformige molekyler af halogenerne. Fra top til bund: fluor (Ftochlor, Cl (Clto), brom (Brto) og jod (Ito). Hver af disse har evnen til at reagere med det store flertal af elementer, selv mellem kongenere i den samme gruppe (interhalogener).
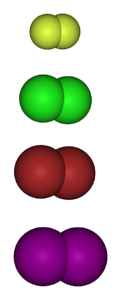
Halogenerede derivater har således formlen MX, hvis det er et metalhalogenid, RX, hvis det er alkyl, og ArX, hvis det er aromatisk. De sidste to er i kategorien organiske halogenider. Stabiliteten af disse forbindelser kræver en "energifordel" sammenlignet med det originale gasmolekyle.
Som en generel regel danner fluor mere stabile halogenerede derivater end iod. Årsagen skyldes forskellene mellem deres atomare radier (de lilla kugler er mere voluminøse end de gule).
Efterhånden som atomradien stiger, er overlapningen af orbitalerne mellem halogenet og det andet atom ringere, og derfor er båndet svagere..
Artikelindeks
- 1 Nomenklatur
- 1.1 Uorganiske stoffer
- 1.2 Organisk
- 2 egenskaber
- 2.1 Uorganiske halogenider
- 2.2 Organiske halogenider
- 3 anvendelser
- 4 Yderligere eksempler
- 5 Referencer
Nomenklatur
Den korrekte måde at navngive disse forbindelser afhænger af, om de er uorganiske eller organiske..
Uorganisk
Metalhalogenider består af en binding, ionisk eller kovalent, mellem et halogen X og et metal M (fra gruppe 1 og 2, overgangsmetaller, tungmetaller osv.).
I disse forbindelser har alle halogener en oxidationstilstand på -1. Hvorfor? Fordi dens valensindstillinger er nstonp5.
Derfor er de nødt til kun at få en elektron for at fuldføre valensoktet, mens metaller oxiderer, hvilket giver dem de elektroner, de har til rådighed..
Således forbliver fluoren som F-, fluor; Cl-, chlorid; BR-, bromid; og jeg-, Jeg sidst. MF ville blive navngivet: (metalnavn) fluorid (n), hvor n kun er metalets valens, når det har mere end en. For metaller i gruppe 1 og 2 er det ikke nødvendigt at navngive valensen.
Eksempler
- NaF: natriumfluorid.
- CaClto: Kalcium Klorid.
- AgBr: sølvbromid.
- ZnIto: zinkiodid.
- CuCl: kobber (I) chlorid.
- CuClto: kobber (II) chlorid.
- TiCl4: titanium (IV) chlorid eller titantetrachlorid.
Imidlertid kan brint og ikke-metalelementer - selv halogener selv - også danne halogenider. I disse tilfælde er valensen af ikke-metal ikke navngivet i slutningen:
- PCl5: fosforpentachlorid.
- BF3: bortrifluorid.
- Ali3: aluminiumtriiodid.
- HBr: hydrogenbromid.
- HVIS7: jodheptafluorid.
Økologisk
Uanset om det er RX eller ArX, er halogen bundet kovalent til et carbonatom. I disse tilfælde er halogener nævnt med deres navne, og resten af nomenklaturen afhænger af den molekylære struktur af R eller Ar.
For det enkleste organiske molekyle er methan (CH4Følgende derivater opnås ved at erstatte Cl med Cl:
- CH3Cl: chlormethan.
- CHtoClto: dichlormethan.
- CHCl3: trichlormethan (chloroform).
- CCl4: tetrachlormethan (carbon (IV) chlorid eller carbontetrachlorid).
Her består R af et enkelt carbonatom. Så for andre alifatiske kæder (lineær eller forgrenet) tælles antallet af carbonatomer, hvorfra det er knyttet til halogenet:
CH3CHtoCHtoF: 1-fluorpropan.
Eksemplet ovenfor var et primært alkylhalogenid. I tilfælde af at kæden er forgrenet, vælges den længste kæde, der indeholder halogenet, og optællingen begynder, så det mindst mulige antal efterlades:
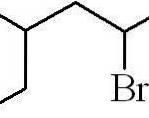
3-methyl-5-bromhexan
Det samme sker for andre substituenter. Ligeledes kaldes halogenet for aromatiske halogenider og derefter resten af strukturen:
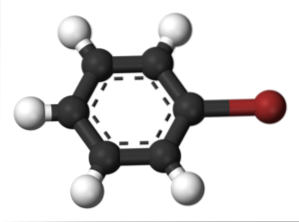
Det øverste billede viser forbindelsen kaldet brombenzen og fremhæver bromatomet i brunt.
Ejendomme
Uorganiske halogenider
Uorganiske halogenider er ioniske eller molekylære faste stoffer, skønt førstnævnte er mere rigelige. Afhængigt af interaktionerne og ioniske radier af MX vil det være opløseligt i vand eller andre mindre polære opløsningsmidler.
Ikke-metalliske halogenider (såsom borhalogenider) er generelt Lewis-syrer, hvilket betyder, at de accepterer elektroner til dannelse af komplekser. På den anden side producerer hydrogenhalogenider (eller halogenider) opløst i vand såkaldte hydracider..
Dets smelte-, kogepunkts- eller sublimeringspunkter falder på de elektrostatiske eller kovalente interaktioner mellem metallet eller ikke-metal med halogenet..
Ligeledes spiller ioniske radier en vigtig rolle i disse egenskaber. For eksempel hvis M+ og X- har lignende størrelser, vil dine krystaller være mere stabile.
Organiske halogenider
De er polære. Hvorfor? Fordi forskellen i elektronegativiteter mellem C og halogen skaber et permanent polært øjeblik i molekylet. Ligeledes aftager dette, når gruppe 17 falder ned, fra CF-binding til C-I.
Uanset den molekylære struktur af R eller Ar påvirker det stigende antal halogener kogepunkterne direkte, da de øger molmassen og de intermolekylære interaktioner (RC-X-X-CR). De fleste er blandbare med vand, men kan opløses i organiske opløsningsmidler.
Ansøgninger
Anvendelsen af de halogenerede derivater kan reservere deres egen tekst. De molekylære "partnere" af halogener er en nøglefaktor, da deres egenskaber og reaktiviteter definerer anvendelsen af derivatet..
Blandt den store mangfoldighed af mulige anvendelser skiller følgende sig således ud:
- Molekylære halogener bruges til at skabe halogenpærer, hvor de kommer i kontakt med glødelampen af wolfram. Formålet med denne blanding er at reagere halogen X med fordampet wolfram. På denne måde undgås dets aflejring på pærens overflade, hvilket garanterer en længere levetid..
- Fluorsalte bruges til fluorering af vand og tandpastaer.
- Natrium- og calciumhypochloritter er to aktive stoffer i kommercielle blegemiddelopløsninger (klor)..
- Selvom de beskadiger ozonlaget, anvendes klorfluorcarboner (CFC'er) i aerosoler og kølesystemer..
- Vinylchlorid (CHto= CHCl) er monomeren af polyvinylchlorid (PVC) polymeren. På den anden side består teflon, der anvendes som et non-stick materiale, af polymerkæder af tetrafluorethylen (FtoC = CFto).
- De bruges i analytisk kemi og i organiske synteser til forskellige formål; blandt disse syntesen af stoffer.
Yderligere eksempler
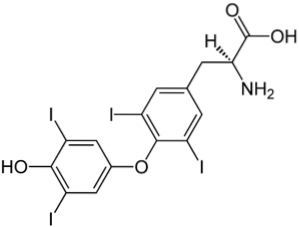
Det øverste billede illustrerer skjoldbruskkirtelhormonet, der er ansvarlig for produktionen af varme såvel som forøgelsen af det generelle stofskifte i kroppen. Denne forbindelse er et eksempel på et halogeneret derivat til stede i den menneskelige krop.
Blandt andre halogenerede forbindelser er følgende nævnt:
- Dichlordiphenyltrichlorethan (DDT), effektivt insekticid men med alvorlige miljøpåvirkninger.
- Tinchlorid (SnClto), anvendt som et reduktionsmiddel.
- Chlorethan eller 1-chlorethan (CH3CHtoCl), et topisk bedøvelsesmiddel, der virker hurtigt ved at afkøle huden.
- Dichlorethylen (ClCH = CClH) og tetrachlorethylen (CltoC = CClto), der anvendes som opløsningsmidler i renserisektoren.
Referencer
- Dr. Ian Hunt. Grundlæggende IUPAC Organisk Nomenklatur Haloalkaner / Alkylhalogenider. Hentet den 4. maj 2018 fra: chem.ucalgary.ca
- Richard C. Banks. (August 2000). Nomenklatur for organiske halider. Hentet den 4. maj 2018 fra: chemistry.boisestate.edu
- Advameg, Inc. (2018). Organiske halogenforbindelser. Hentet den 4. maj 2018 fra: chemistryexplained.com
- Organiske halogenforbindelser. Hentet den 4. maj 2018 fra: 4college.co.uk
- Dr. Seham Alterary. (2014). Organiske halogenforbindelser. Hentet den 4. maj 2018 fra: fac.ksu.edu.sa
- Clark J. Fysiske egenskaber af alkylhalider. Hentet den 4. maj 2018 fra: chem.libretexts.org
- Dr. Manal K. Rasheed. Organiske halider. Hentet den 4. maj 2018 fra: comed.uobaghdad.edu.iq



Endnu ingen kommentarer