
Proteindenatureringsfaktorer og konsekvenser

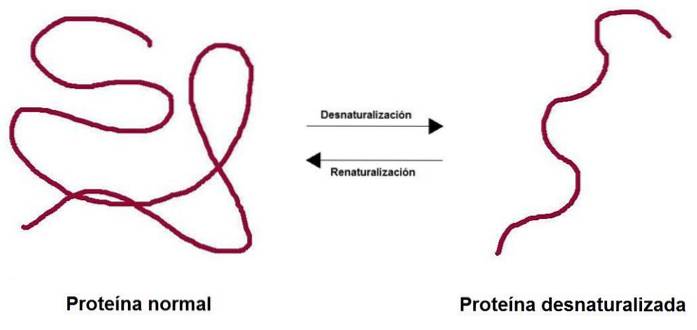
Det protein denaturering Den består af tabet af den tredimensionelle struktur på grund af forskellige miljøfaktorer, såsom temperatur, pH eller visse kemiske stoffer. Tabet af strukturen resulterer i tabet af den biologiske funktion, der er forbundet med det protein, det være sig enzymatisk, strukturelt, transporterende, blandt andre..
Proteinstrukturen er meget følsom over for ændringer. Destabiliseringen af en enkelt essentiel hydrogenbinding kan denaturere proteinet. Tilsvarende er der interaktioner, der ikke er strengt nødvendige for at udføre proteinfunktionen, og hvis de er destabiliserede, har de ingen virkning på funktionen..
Artikelindeks
- 1 Struktur af proteiner
- 1.1 Primær struktur
- 1.2 Sekundær struktur
- 1.3 Tertiær struktur
- 1.4 Kvartær struktur
- 2 Faktorer, der forårsager denaturering
- 2,1 pH
- 2.2 Temperatur
- 2.3 Kemiske stoffer
- 2.4 Reduktionsmidler
- 3 konsekvenser
- 3.1 Renaturering
- 4 Chaperone proteiner
- 5 Referencer
Proteinstruktur
For at forstå proteindenatureringsprocesser skal vi vide, hvordan proteiner er organiseret. Disse nuværende primære, sekundære, tertiære og kvaternære struktur.
Primær struktur
Det er sekvensen af aminosyrer, der udgør proteinet. Aminosyrer er de grundlæggende byggesten, der udgør disse biomolekyler, og der er 20 forskellige typer, hver med særlige fysiske og kemiske egenskaber. De binder sig til hinanden gennem en peptidbinding.
Sekundær struktur
I denne struktur begynder denne lineære kæde af aminosyrer at foldes gennem hydrogenbindinger. Der er to grundlæggende sekundære strukturer: α-spiralen med en spiralform; og det foldede ark β, når to lineære kæder er justeret parallelt.
Tertiær struktur
Involverer andre typer kræfter, der resulterer i specifikke folder i den tredimensionelle form.
R-kæderne af aminosyreresterne, der udgør proteinstrukturen, kan danne disulfidbroer, og de hydrofobe dele af proteinerne klumper sig sammen indefra, mens de hydrofile vender ud mod vandet. Van der Waals kræfter fungerer som en stabilisator af de beskrevne interaktioner.
Kvartær struktur
Består af aggregater af proteinenheder.
Når et protein er denatureret, mister det sin kvaternære, tertiære og sekundære struktur, mens det primære forbliver intakt. Proteiner, der er rige på disulfidbindinger (tertiær struktur) giver større modstand mod denaturering.
Faktorer, der forårsager denaturering
Enhver faktor, der destabiliserer de ikke-kovalente bindinger, der er ansvarlige for at opretholde proteinets native struktur, kan forårsage denaturering. Blandt de vigtigste kan vi nævne:
pH
Ved meget ekstreme pH-værdier, hvad enten det er surt eller basisk, kan proteinet miste sin tredimensionelle konfiguration. Overskydende H-ioner+ og OH- i midten destabiliserer proteininteraktioner.
Denne ændring i ionisk mønster forårsager denaturering. Denaturering ved pH kan være reversibel i nogle tilfælde og irreversibel i andre.
Temperatur
Termisk denaturering opstår med stigende temperatur. I organismer, der lever under gennemsnitlige miljøforhold, begynder proteiner at destabilisere ved temperaturer over 40 ° C. Det er klart, at proteinerne fra termofile organismer kan modstå disse temperaturområder..
Stigninger i temperaturen oversættes til øgede molekylære bevægelser, der påvirker hydrogenbindinger og andre ikke-kovalente bindinger, hvilket resulterer i tab af tertiær struktur..
Disse temperaturstigninger fører til et fald i reaktionshastigheden, hvis vi taler om enzymer.
Kemiske stoffer
Polære stoffer - såsom urinstof - i høje koncentrationer påvirker hydrogenbindinger. Ligeledes kan ikke-polære stoffer have lignende konsekvenser..
Vaskemidler kan også destabilisere proteinstrukturen; det er dog ikke en aggressiv proces, og de er for det meste reversible.
Reduktionsmidler
Β-Mercaptoethanol (HOCH2CH2SH) er et kemisk middel, der ofte bruges i laboratoriet til at denaturere proteiner. Det er ansvarligt for at reducere disulfidbroer mellem aminosyrerester. Kan destabilisere proteinets tertiære eller kvaternære struktur.
Et andet reduktionsmiddel med lignende funktioner er dithiothreitol (DTT). Derudover er andre faktorer, der bidrager til tabet af den oprindelige struktur i proteiner, tungmetaller i høje koncentrationer og ultraviolet stråling..
Konsekvenser
Når denaturering opstår, mister proteinet sin funktion. Proteiner fungerer optimalt, når de er i deres oprindelige tilstand.
Funktionstab er ikke altid forbundet med en denatureringsproces. Det kan være, at en lille ændring i proteinstrukturen fører til tab af funktion uden at destabilisere hele den tredimensionelle struktur.
Processen kan måske ikke være irreversibel. I laboratoriet, hvis forholdene vendes, kan proteinet vende tilbage til sin oprindelige konfiguration.
Renaturering
Et af de mest berømte og afgørende eksperimenter med renaturering blev påvist i ribonuklease A.
Da forskerne tilføjede denatureringsmidler som urinstof eller β-mercaptoethanol, blev proteinet denatureret. Hvis disse stoffer blev fjernet, vendte proteinet tilbage til dets naturlige konformation og kunne udføre dets funktion med 100% effektivitet..
En af de vigtigste konklusioner af denne forskning var at demonstrere eksperimentelt, at den tredimensionelle konformation af proteinet er givet af dets primære struktur.
I nogle tilfælde er denatureringsprocessen fuldstændig irreversibel. For eksempel når vi tilbereder et æg, påfører vi proteinerne (det vigtigste er albumin), der udgør det, den hvide får et solidt og hvidligt udseende. Intuitivt kan vi konkludere, at selvom vi køler det ned, vender det ikke tilbage til dets oprindelige form.
I de fleste tilfælde ledsages denatureringsprocessen af tab af opløselighed. Det reducerer også viskositet, diffusionshastighed og krystalliserer lettere..
Chaperone proteiner
Proteinerne chaperones eller chaperoniner er ansvarlige for at forhindre denaturering af andre proteiner. De undertrykker også visse interaktioner, der ikke er egnede mellem proteiner for at sikre korrekt foldning af det samme..
Når temperaturen på mediet stiger, øger disse proteiner deres koncentration og virker for at forhindre denaturering af andre proteiner. Dette er grunden til, at de også kaldes "varmechokproteiner" eller HSP for dets akronym på engelsk. (Varmechokproteiner).
Chaperoniner er analoge med et bur eller en tønde, der beskytter proteinet af interesse inde.
Disse proteiner, der reagerer på situationer med cellulær stress, er rapporteret i forskellige grupper af levende organismer og er meget konserverede. Der er forskellige klasser af chaperoniner, og de klassificeres efter deres molekylvægt..
Referencer
- Campbell, N. A. og Reece, J. B. (2007). biologi. Panamerican Medical Ed..
- Devlin, T. M. (2004). Biokemi: Lærebog med kliniske applikationer. Omvendt.
- Koolman, J., & Röhm, K. H. (2005). Biokemi: tekst og atlas. Panamerican Medical Ed..
- Melo, V., Ruiz, V. M., og Cuamatzi, O. (2007). Biokemi af metaboliske processer. Vend tilbage.
- Pacheco, D., & Leal, D. P. (2004). Medicinsk biokemi. Redaktionel Limusa.
- Pena, A., Arroyo, A., Gómez, A., & Tapia, R. (1988). Biokemi. Redaktionel Limusa.
- Sadava, D., & Purves, W. H. (2009). Liv: Biologisk videnskab. Panamerican Medical Ed..
- Tortora, G. J., Funke, B. R., og Case, C. L. (2007). Introduktion til mikrobiologi. Panamerican Medical Ed..
- Voet, D., Voet, J. G., & Pratt, C. W. (2007). Fundamentals of Biochemistry. Panamerican Medical Ed..



Endnu ingen kommentarer