
Hydracid-egenskaber, nomenklatur, anvendelser og eksempler

Det hydracider eller binære syrer er forbindelser opløst i vand, der består af hydrogen og et ikke-metallisk element: hydrogenhalogenider. Dens generelle kemiske formel kan udtrykkes som HX, hvor H er hydrogenatomet, og X er det ikke-metalliske element..
X kan høre til gruppe 17, halogenerne eller til elementerne i gruppe 16 uden at inkludere ilt. I modsætning til oxosyrer mangler hydracider ilt. Da hydracider er kovalente eller molekylære forbindelser, skal H-X-bindingen overvejes. Dette er af stor betydning og definerer karakteristika for hver hydracid..
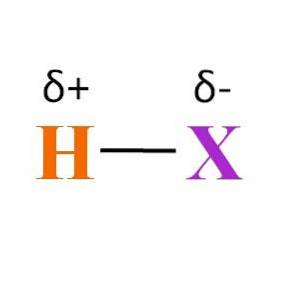
Hvad med H-X-båndet? Som det kan ses på billedet ovenfor, er der et permanent dipolmomentprodukt af de forskellige elektronegativiteter mellem H og X. Da X normalt er mere elektronegativ end H, tiltrækker det sin elektroniske sky og ender med en negativ delvis ladning δ-.
På den anden side ender det ved at give en del af sin elektrondensitet til X en positiv delvis ladning δ +. Jo mere negativ δ-, jo rigere er elektroner X, og jo større er elektronmangel af H. Derfor kan en hydracid afhængigt af hvilket element X er være mere eller mindre polær.
Billedet afslører også strukturen på hydraciderne. HX er et lineært molekyle, som kan interagere med et andet i en af dens ender. Jo mere polær HX er, jo stærkere eller affinitet vil dets molekyler interagere med. Som et resultat vil dets kogepunkter eller smeltepunkter stige.
Imidlertid er H-X-H-X-interaktionerne stadig svage nok til at give anledning til et fast hydrat. Af denne grund er de under gas- og omgivelsestemperatur gasformige stoffer; Med undtagelse af HF, som fordamper over 20 ° C.
Hvorfor? Fordi HF er i stand til at danne stærke hydrogenbindinger. Mens de andre hydracider, hvis ikke-metalliske grundstoffer er mindre elektronegative, kan de næppe være i væskefasen under 0 ° C. HCI koger f.eks. Ved ca. -85 ° C.
Er hydracider sure stoffer? Svaret ligger i den positive delvise ladning δ + på hydrogenatomet. Hvis δ + er meget stor, eller H-X-bindingen er meget svag, vil HX være en stærk syre; som med alle hydrogensyrer i halogener, når deres respektive halogenider er opløst i vand.
Artikelindeks
- 1 Funktioner
- 1.1 Fysisk
- 1.2 Kemi
- 2 Nomenklatur
- 2.1 Vandfri form
- 2.2 I vandig opløsning
- 3 Hvordan dannes de??
- 3.1 Direkte opløsning af hydrogenhalogenider
- 3.2 Opløsning af salte af ikke-metaller med syrer
- 4 anvendelser
- 4.1 Rengøringsmidler og opløsningsmidler
- 4.2 Syrekatalysatorer
- 4.3 Reagenser til syntese af organiske og uorganiske forbindelser
- 5 eksempler
- 5.1 HF, flussyre
- 5.2 H2S, hydrogensulfid
- 5.3 HCI, saltsyre
- 5,4 HBr, brombrintesyre
- 5,5 H2Te, tellurvandsyre
- 6 Referencer
Egenskaber
Fysisk
-Synligt er alle hydracider gennemsigtige opløsninger, da HX er meget opløseligt i vand. De kan have gule toner i henhold til koncentrationerne af opløst HX.
-De er rygere, hvilket betyder, at de afgiver tætte, ætsende og irriterende dampe (nogle af dem er endda kvalmende). Dette skyldes, at HX-molekylerne er meget flygtige og interagerer med vanddampen i mediet omkring opløsningerne. Desuden er HX i dets vandfrie former gasformige forbindelser..
-Hydracids er gode ledere af elektricitet. Skønt HX er luftformige arter under atmosfæriske forhold, frigiver de ioner (når de opløses i vand)+x-), som tillader passage af elektrisk strøm.
-Dens kogepunkter er højere end de vandfrie former. Det vil sige, HX (ac), som betegner hydraciden, koger ved temperaturer over HX (g). For eksempel koger hydrogenchlorid, HCI (g) ved -85 ° C, men saltsyre, dens hydracid, omkring 48 ° C..
Hvorfor? Fordi de gasformige HX-molekyler er omgivet af dem fra vand. To typer interaktioner kan forekomme på samme tid: hydrogenbindinger, HX - HtoO - HX eller ionopløsning, H3ELLER+(ac) og X-(ac). Denne kendsgerning er direkte relateret til de kemiske egenskaber ved hydracider..
Kemisk
Hydracider er meget sure opløsninger, så de har sure protoner H3ELLER+ tilgængelige til at reagere med andre stoffer. Hvor går H3ELLER+? Fra hydrogenatomet med en positiv delvis ladning δ +, der dissocieres i vand og ender med at blive kovalent inkorporeret i et vandmolekyle:
HX (aq) + HtoO (l) <=> x-(ac) + H3ELLER+(ac)
Bemærk, at ligningen svarer til en reaktion, der skaber en ligevægt. Når dannelsen af X-(ac) + H3ELLER+(ac) er termodynamisk meget foretrukket, frigiver HX sin sure proton i vand; og så denne med H3ELLER+ som sin nye "bærer" kan den reagere med en anden forbindelse, selvom sidstnævnte ikke er en stærk base.
Ovenstående forklarer de sure egenskaber ved hydracider. Dette er tilfældet for al HX opløst i vand; men nogle genererer mere sure opløsninger end andre. For hvad er dette? Årsagerne kan være meget komplicerede. Ikke alle HX (ac) favoriserer den forreste ligevægt mod højre, det vil sige mod X-(ac) + H3ELLER+(ac).
Surhed
Og undtagelsen observeres i flussyre, HF (aq). Fluor er meget elektronegativ, derfor forkorter det afstanden til H-X-bindingen og styrker den mod dens nedbrydning ved vandets virkning..
Ligeledes har HF-bindingen meget bedre overlapning af atomare radiusårsager. På den anden side er H-Cl-, H-Br- eller H-I-bindingerne svagere og har tendens til at adskille sig fuldstændigt i vand til det punkt, at de bryder balancen hævet ovenfor..
Dette skyldes, at de andre halogener eller chalcogener (f.eks. Svovl) har større atomradier og derfor større orbitaler. Derfor præsenterer H-X-bindingen dårligere orbital overlapning, da X er større, hvilket igen påvirker syrekraften, når den er i kontakt med vand..
På denne måde er den faldende surhedsrækkefølge for hydrogensyrerne i halogenerne som følger: HF< HCl
Nomenklatur
Vandfri form
Hvordan navngives hydracider? I deres vandfri former, HX (g), skal de nævnes som dikteret for hydrogenhalogenider: tilføjelse af suffikset -ide til slutningen af deres navne.
F.eks. Består HI (g) af et halogenid (eller hydrid) dannet af hydrogen og iod, derfor er dets navn: iodaurochs hydrogen. Da ikke-metaller generelt er mere elektronegative end brint, har det et oxidationsnummer på +1. I NaH har brint på den anden side et oxidationsnummer på -1.
Dette er en anden indirekte måde at differentiere molekylære hydrider fra halogener eller hydrogenhalogenider fra andre forbindelser..
Når HX (g) kommer i kontakt med vand, er det repræsenteret som HX (ac), og så har vi hydratet.
I vandig opløsning
For at navngive hydraciden, HX (ac), skal suffikset -id af dets vandfrie former erstattes med suffikset -hydric. Og de skal først nævnes som syrer. For ovenstående eksempel betegnes HI (ac) således: syrejodhydric.
Hvordan dannes de?
Direkte opløsning af hydrogenhalogenider
Hydracider kan dannes ved simpelthen at opløse deres tilsvarende hydrogenhalogenider i vand. Dette kan repræsenteres af følgende kemiske ligning:
HX (g) => HX (ac)
HX (g) er meget opløseligt i vand, så der er ingen balance mellem opløselighed, i modsætning til dens ioniske dissociation for at frigive sure protoner.
Der er imidlertid en syntetisk metode, der foretrækkes, fordi den bruger salte eller mineraler som råmateriale, der opløses ved lave temperaturer med stærke syrer..
Opløsning af salte af ikke-metaller med syrer
Hvis bordsalt, NaCl, opløses med koncentreret svovlsyre, opstår følgende reaktion:
NaCl (s) + HtoSW4(aq) => HCI (aq) + NaHSO4(ac)
Svovlsyre donerer en af dens sure protoner til chloranionen Cl-, således omdannes det til saltsyre. Brintchlorid, HCI (g), kan undslippe fra denne blanding, fordi den er meget flygtig, især hvis koncentrationen i vand er meget høj. Det andet producerede salt er natriumsyresulfat, NaHSO4.
En anden måde at producere det på er at erstatte svovlsyre med koncentreret fosforsyre:
NaCl (s) + H3PO4(aq) => HCI (aq) + NaHtoPO4(ac)
H3PO4 reagerer på samme måde som HtoSW4, producerer saltsyre og natriumdiacidphosphat. NaCl er kilden til anionen Cl-, således at der er behov for salte eller mineraler indeholdende F for at syntetisere de andre hydracider-, Br-, jeg-, Sto-, etc.
Men brugen af HtoSW4 eller H3PO4 det vil afhænge af dets oxidationsstyrke. HtoSW4 Det er et meget stærkt oxidationsmiddel, til det punkt, at det oxiderer selv Br- og jeg- til deres molekylære former Brto og jegto; den første er en rødlig væske og den anden et lilla fast stof. Derfor er H3PO4 repræsenterer det foretrukne alternativ i sådanne synteser.
Ansøgninger
Rengøringsmidler og opløsningsmidler
Hydracider bruges i det væsentlige til at opløse forskellige typer stof. Dette skyldes, at de er stærke syrer og kan rense enhver overflade i moderation..
Dens sure protoner tilsættes forbindelserne med urenheder eller snavs, hvilket gør dem opløselige i det vandige medium og trækkes derefter af vandet.
Afhængigt af overfladens kemiske natur kan en eller anden hydracid anvendes. For eksempel kan flussyre ikke bruges til at rense glas, da det vil opløse dem på stedet. Saltsyre bruges til at fjerne pletter fra swimmingpoolsfliser.
De er også i stand til at opløse sten eller faste prøver og derefter bruges til analytiske eller produktionsformål i små eller store skalaer. Ved ionbytningskromatografi anvendes fortyndet saltsyre til at rense søjlen for resterende ioner..
Syrekatalysatorer
Nogle reaktioner kræver meget sure opløsninger for at fremskynde dem og reducere den tid, de finder sted. Det er her hydraciderne kommer ind.
Et eksempel på dette er anvendelsen af hydroiodsyre til syntesen af iseddikesyre. Olieindustrien har også brug for hydracider i raffinaderiprocesser.
Reagenser til syntese af organiske og uorganiske forbindelser
Hydracider tilvejebringer ikke kun sure protoner, men også deres respektive anioner. Disse anioner kan reagere med en organisk eller uorganisk forbindelse til dannelse af et specifikt halogenid. På denne måde kan de syntetiseres: fluorider, chlorider, iodider, bromider, selenider, sulfider og andre forbindelser mere.
Disse halogenider kan have meget forskellige anvendelser. For eksempel kan de anvendes til at syntetisere polymerer, såsom Teflon; eller mellemled, hvorfra halogenatomer vil blive inkorporeret i molekylære strukturer af visse lægemidler.
Antag, at molekylet CH3CHtoOH, ethanol, reagerer med HCI til dannelse af ethylchlorid:
CH3CHtoOH + HCI => CH3CHtoCl + HtoELLER
Hver af disse reaktioner skjuler en mekanisme og mange aspekter, der overvejes i organiske synteser..
Eksempler
Der er ikke mange eksempler til rådighed for hydracider, da antallet af mulige forbindelser naturligt er begrænset. Af denne grund er nogle yderligere hydracider angivet nedenfor med deres respektive nomenklatur (forkortelsen (ac) ignoreres):
HF, flussyre
Binær hydracid, hvis HF-molekyler danner stærke hydrogenbindinger, til det punkt, at det i vand er en svag syre.
HtoS, hydrogensulfid
I modsætning til de hidtil betragtede hydracider er det polyatomisk, dvs. det har mere end to atomer, men det fortsætter med at være binært, da det er to elementer: svovl og brint..
Dens kantede HS-H-molekyler danner ikke mærkbare hydrogenbindinger og kan detekteres ved deres karakteristiske rådne ægluft..
HC1, saltsyre
En af de mest kendte syrer i populærkulturen. Det er endda en del af sammensætningen af mavesaft, der er til stede i maven, og sammen med fordøjelsesenzymer nedbryder de mad.
HBr, brombrintesyre
Ligesom hydroiodsyre består den i gasfasen af lineære H-Br-molekyler, der adskiller sig i H-ioner+ (H3ELLER+) og Br- når de kommer ind i vandet.
HtoTe, saltsyre
Selvom tellur har en vis metallisk karakter, afgiver dets hydracid ubehagelige og meget giftige dampe, såsom hydrogenselenid..
Som de andre hydracider af chalcogenider (fra gruppe 16 i det periodiske system) producerer den i opløsning anionen Teto-, så dens valens er -2.
Referencer
- Clark J. (22. april 2017). Surhedsgraden af hydrogenhalogeniderne. Gendannet fra: chem.libretexts.org
- Lumen: Introduktion til kemi. Binære syrer. Hentet fra: courses.lumenlearning.com
- Helmenstine, Anne Marie, Ph.D. (22. juni 2018). Definition af binær syre. Gendannet fra: thoughtco.com
- Mr. Scott. Kemisk formelskrivning og nomenklatur. [PDF]. Gendannet fra: celinaschools.org
- Madhusha. (9. februar 2018). Skel mellem binære syrer og oxysyrer. Gendannet fra: pediaa.com
- Wikipedia. (2018). Hydratsyre. Gendannet fra: es.wikipedia.org
- Natalie Andrews. (24. april 2017). Anvendelsen af hydriodinsyre. Gendannet fra: sciencing.com
- StudiousGuy. (2018). Flussyre: Vigtige anvendelser og applikationer. Gendannet fra: studiousguy.com


Endnu ingen kommentarer