
Deuteriums struktur, egenskaber og anvendelser
Det deuterium er en af de isotopiske arter af hydrogen, som er repræsenteret som D eller toH. Desuden er det blevet kaldt tungt brint, fordi dets masse er dobbelt så stor som protonen. En isotop er en art, der kommer fra det samme kemiske element, men hvis massetal er forskelligt fra dette.
Denne forskel skyldes forskellen i antallet af neutroner, den har. Deuterium betragtes som en stabil isotop og kan findes i naturligt forekommende hydrogenforbindelser, skønt i en forholdsvis lille andel (mindre end 0,02%).
På grund af dets egenskaber, der minder meget om almindeligt brint, kan det erstatte brint i alle de reaktioner, det deltager i, og bliver ækvivalente stoffer..
Af denne og andre grunde har denne isotop et stort antal anvendelser inden for forskellige videnskabelige områder og bliver en af de vigtigste.
Artikelindeks
- 1 Struktur
- 1.1 Nogle fakta om deuterium
- 2 egenskaber
- 3 anvendelser
- 4 Referencer
Struktur
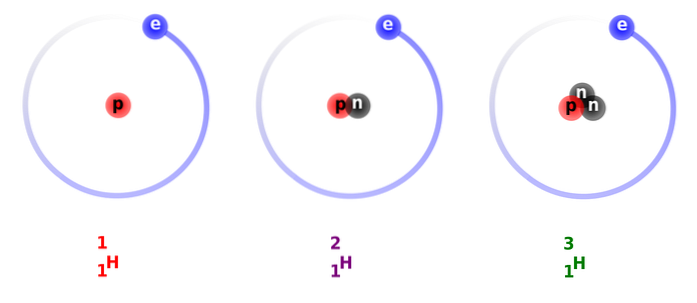
Strukturen af deuterium udgøres hovedsageligt af en kerne, der har en proton og en neutron, med en atomvægt eller masse på ca. 2.014 g.
Tilsvarende skylder denne isotop sin opdagelse til Harold C. Urey, en kemiker fra De Forenede Stater, og hans samarbejdspartnere Ferdinand Brickwedde og George Murphy i 1931..
På billedet ovenfor kan du se sammenligningen mellem strukturerne af brintisotoper, der findes i form af protium (dens mest rigelige isotop), deuterium og tritium, bestilt fra venstre mod højre.
Fremstillingen af deuterium i ren tilstand blev udført med succes for første gang i 1933, men siden 1950'erne er der anvendt et stof i fast fase og har vist stabilitet, kaldet lithium deuterid (LiD), til erstatning af deuterium og tritium i en stort antal kemiske reaktioner.
I denne forstand er overfladen af denne isotop blevet undersøgt, og det er blevet observeret, at dens andel i vand kan variere lidt afhængigt af kilden, hvorfra prøven tages..
Derudover har spektroskopiundersøgelser bestemt eksistensen af denne isotop på andre planeter i denne galakse..
Nogle fakta om deuterium
Som nævnt ovenfor ligger den grundlæggende forskel mellem brintisotoper (som er de eneste, der er blevet navngivet på forskellige måder) i deres struktur, fordi antallet af protoner og neutroner i en art giver det dets kemiske egenskaber.
På den anden side elimineres deuterium inde i stjernekroppene med større hastighed end det stammer fra.
Derudover anses det for, at andre naturfænomener kun udgør en lille mængde af det, så dets produktion fortsætter med at skabe interesse i dag.
Tilsvarende har en række undersøgelser afsløret, at langt størstedelen af de atomer, der er dannet af denne art, stammer fra Big Bang; dette er grunden til, at dets tilstedeværelse bemærkes på store planeter som Jupiter.
Da den mest almindelige måde at opnå denne art på i naturen er, når den findes i kombination med brint i form af protium, fortsætter forholdet, der er etableret mellem andelen af begge arter inden for forskellige videnskabelige områder, at vække det videnskabelige samfunds interesse. såsom astronomi eller klimatologi.
Ejendomme
- Det er en isotop blottet for radioaktive egenskaber; det vil sige, det er ret stabilt i naturen.
- Det kan bruges til at erstatte hydrogenatomet i kemiske reaktioner.
- Denne art viser en adfærd, der er forskellig fra almindeligt brint i reaktioner af biokemisk karakter..
- Når de to brintatomer udskiftes i vand, får vi DtoEller erhverve navnet på tungt vand.
- Brintet til stede i havet i form af deuterium findes i en andel på 0,016% i forhold til protiumet.
- I stjerner har denne isotop en tendens til hurtigt at smelte sammen og give anledning til helium..
- DtoO er en giftig art, skønt dens kemiske egenskaber svarer meget til Hto
- Når deuteriumatomer udsættes for kernefusionsprocessen ved høje temperaturer, frigøres store mængder energi.
- Fysiske egenskaber såsom kogepunkt, tæthed, fordampningsvarme, tredobbelt punkt, blandt andre, har højere størrelser i deuteriummolekyler (Dto) end i hydrogen (Hto).
- Den mest almindelige form, hvori den findes, er bundet til et hydrogenatom, der forårsager hydrogendeuterid (HD).
Ansøgninger
På grund af dets egenskaber anvendes deuterium til en lang række anvendelser, hvor brint er involveret. Nogle af disse anvendelser er beskrevet nedenfor:
- Inden for biokemi bruges det til isotopmarkering, som består i at "markere" en prøve med den valgte isotop for at spore den gennem dens passage gennem et specifikt system..
- I atomreaktorer, der udfører fusionsreaktioner, bruges det til at reducere den hastighed, hvormed neutroner bevæger sig uden den høje absorption af disse, som almindeligt brint præsenterer..
- Inden for kernemagnetisk resonans (NMR) anvendes opløsningsmidler baseret på deuterium til at opnå prøver af denne type spektroskopi uden tilstedeværelse af interferenser, der opstår, når der anvendes hydrogenerede opløsningsmidler..
- Inden for biologi undersøges makromolekyler gennem neutronspredningsteknikker, hvor prøver forsynet med deuterium bruges til signifikant at reducere støj i disse kontrastegenskaber..
- Inden for farmakologi anvendes substitution af hydrogen til deuterium på grund af den kinetiske isotopiske effekt, der genereres, og gør det muligt for disse lægemidler at have en længere halveringstid.
Referencer
- Britannica, E. (s.f.). Deuterium. Gendannet fra britannica.com
- Wikipedia. (s.f.). Deuterium. Hentet fra en.wikipedia.org
- Chang, R. (2007). Chemistry, niende udgave. Mexico: McGraw-Hill.
- Hyperfysik. (s.f.). Deuterium overflod. Gendannet fra hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Deuterium fakta. Hentet fra thoughtco.com



Endnu ingen kommentarer