
Moeller-diagram over, hvad det består og øvelser løst
Det Moeller-diagram o Regnmetode er en grafisk og mindeværdig metode til at lære Madelungs regel; det vil sige hvordan man skriver elektronkonfigurationen for et element. Det er kendetegnet ved at tegne diagonaler gennem orbitalernes søjler, og efter pilens retning etableres den passende rækkefølge af det samme for et atom.
I nogle dele af verden er Moeller-diagrammet også kendt som regn metode. Gennem dette defineres en rækkefølge i udfyldningen af orbitalerne, som også er defineret af de tre kvantetal n, l Y ml.
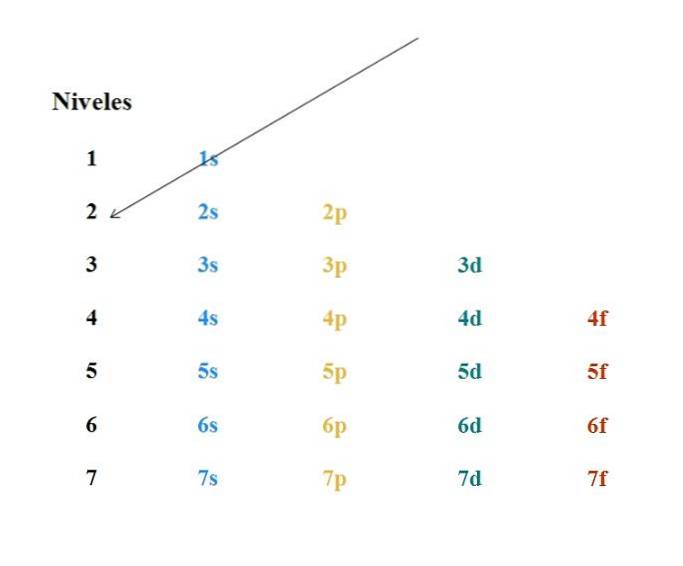
Et simpelt Moeller-diagram er vist på billedet ovenfor. Hver søjle svarer til forskellige orbitaler: s, p, d og f med deres respektive energiniveauer. Den første pil indikerer, at fyldningen af ethvert atom skal begynde med 1s-orbitalen.
Således skal den næste pil starte fra 2s orbital og derefter fra 2p gennem 3s orbital. På denne måde, som om det var en regn, indeholder orbitalerne og antallet af elektroner de indeholder (4l+to).
Moeller-diagrammet repræsenterer en introduktion for dem, der studerer elektronkonfigurationer..
Artikelindeks
- 1 Hvad er Moeller-diagrammet?
- 1.1 Madelungs regel
- 1.2 Skridt, der skal følges
- 2 Løst øvelser
- 2.1 Beryllium
- 2.2 Fosfor
- 2.3 Zirkonium
- 2.4 Iridium
- 2.5 Undtagelser fra Moeller-diagrammet og Madelungs regel
- 3 Referencer
Hvad er Moeller-diagrammet?
Madelungs styre
Da Moeller-diagrammet består af en grafisk gengivelse af Madelungs regel, er det nødvendigt at vide, hvordan sidstnævnte fungerer. Udfyldningen af orbitalerne skal overholde følgende to regler:
-Orbitalerne med de laveste værdier på n+l fyldes først, bliver n hovedkvantumnummeret og l det orbitale kantede momentum. For eksempel svarer 3d-orbital til n= 3 og l= 2, derfor, n+l= 3 + 2 = 5; i mellemtiden svarer 4s orbital til n= 4 og l= 0 og n+l= 4 + 0 = 4. Fra ovenstående er det fastslået, at elektronerne fylder 4s orbitalen først end den 3d.
-Hvis to orbitaler har den samme værdi af n+l, elektronerne optager først den med den laveste værdi på n. For eksempel har 3d-orbitalen en værdi på n+l= 5, ligesom 4p orbitalen (4 + 1 = 5); men siden 3d har den mindste værdi af n, fyldes op tidligere end 4p.
Fra de to foregående observationer kan følgende rækkefølge for orbitalerne nås: 1s 2s 2p 3s 3p 4s 3d 4p.
Ved at følge de samme trin for forskellige værdier af n+l for hver orbital opnås de elektroniske konfigurationer af andre atomer; hvilket igen også kan bestemmes grafisk af Moeller-diagrammet.
Trin til at følge
Madelungs regel siger formlen n+l, med hvilken den elektroniske konfiguration kan "tilkobles". Imidlertid repræsenterer Moeller-diagrammet som nævnt allerede grafisk dette; så følg bare kolonnerne og tegn diagonaler trin for trin.
Hvordan starter man så den elektroniske konfiguration af et atom? For at gøre dette skal du først kende dets atomnummer Z, som pr. Definition for et neutralt atom er lig med antallet af elektroner.
Således opnås antallet af elektroner med Z, og med dette i tankerne begynder vi at tegne diagonaler gennem Moeller-diagrammet.
Orbitalerne kan rumme to elektroner (anvendelse af formlen 4l+2), p seks elektroner, d ti og f fjorten. Det stopper ved kredsløbet, hvor den sidste elektron givet af Z er blevet besat.
For yderligere afklaring nedenfor er der en række løste øvelser.
Løst øvelser
Beryllium
Ved hjælp af det periodiske system er elementet beryllium placeret med Z = 4; det vil sige, at dens fire elektroner skal placeres i orbitalerne.
Startende med den første pil i Moeller-diagrammet optager 1s orbital to elektroner: 1sto; efterfulgt af 2s orbital med to ekstra elektroner til at tilføje op til 4 i alt: 2sto.
Derfor er berylliums elektronkonfiguration, udtrykt som [Be], 1sto2sto. Bemærk, at summeringen af overskrifterne er lig med antallet af samlede elektroner.
Match
Elementet fosfor har en Z = 15, og derfor har den i alt 15 elektroner, som skal optage orbitalerne. For at komme videre, starter du straks med 1s-indstillingento2sto, som indeholder 4 elektroner. Derefter mangler der 9 flere elektroner.
Efter 2s-orbitalen "kommer" næste pil gennem 2p-orbitalen og lander endelig i 3s-orbitalen. Da 2p-orbitaler kan optage 6 elektroner og 3s 2 elektroner, har vi: 1sto2sto2 s63sto.
Der mangler stadig 3 flere elektroner, som optager følgende 3p-orbital i henhold til Moeller-diagrammet: 1sto2sto2 s63sto3p3, elektronkonfiguration af fosfor [P].
Zirkonium
Elementet zirconium har en Z = 40. Forkortelsessti med 1s opsætningto2sto2 s63sto3p6, med 18 elektroner (den fra ædelgasargonen), så mangler der 22 flere elektroner. Efter 3p-orbitalen er den næste, der udfyldes i henhold til Moeller-diagrammet, orbitalerne 4s, 3d, 4p og 5s.
Udfylde dem fuldstændigt, det vil sige 4'erto, 3d10, 4p6 og 5'erto, i alt 20 elektroner tilføjes. De 2 resterende elektroner er derfor anbragt i følgende orbital: 4d. Elektronkonfigurationen af zirconium, [Zr] er således: 1sto2sto2 s63sto3p64sto3d104p65sto4dto.
Iridium
Iridium har en Z = 77, så den har 37 ekstra elektroner sammenlignet med zirconium. Startende fra [Cd], dvs. 1sto2sto2 s63sto3p64sto3d104p65sto4d10, tilføj 29 elektroner med følgende orbitaler i Moeller-diagrammet.
Tegning af nye diagonaler, de nye orbitaler er: 5p, 6s, 4f og 5d. Udfyldning af de første tre orbitaler helt har vi: 5p6, 6sto og 4f14, giver i alt 22 elektroner.
Så der mangler 7 elektroner, som er i 5d: 1s orbital.to2sto2 s63sto3p64sto3d104p65sto4d105 s66sto4f145 d7.
Ovenstående er elektronkonfigurationen af iridium, [Go]. Bemærk, at 6s orbitalerto og 5d7 er fremhævet med fed skrift for at indikere, at de svarer korrekt til valenslaget på dette metal.
Undtagelser fra Moeller-diagrammet og Madelungs regel
Der er mange elementer i det periodiske system, der ikke adlyder det, der lige er blevet forklaret. Deres elektronkonfigurationer adskiller sig eksperimentelt fra dem, der forudsiges af kvanteårsager..
Blandt de elementer, der præsenterer disse uoverensstemmelser, er: krom (Z = 24), kobber (Z = 29), sølv (Z = 47), rhodium (Z = 45), cerium (Z = 58), niob (Z = 41) og mange flere.
Undtagelser er meget hyppige i udfyldningen af d- og f-orbitalerne. For eksempel bør krom have en valensindstilling på 4sto3d4 ifølge Moellers diagram og Madelungs regel, men det er faktisk 4'er13d5.
Og endelig skal sølvvalensindstillingen være 5sto4d9; men det er virkelig 5'ere14d10.
Referencer
- Gavira J. Vallejo M. (6. august 2013). Undtagelser fra Madelungs regel og Melleres diagram i den elektroniske konfiguration af kemiske grundstoffer. Gendannet fra: triplenlace.com
- Min superklasse. (s.f.) Hvad er elektronkonfiguration? Gendannet fra: misuperclase.com
- Wikipedia. (2018). Moeller-diagram. Gendannet fra: es.wikipedia.org
- Dummies. (2018). Sådan repræsenteres elektroner i et energiniveau-diagram. Gendannet fra: dummies.com
- Nave R. (2016). Bestilling af udfyldning af elektronstater. Gendannet fra: hyperphysics.phy-astr.gsu.edu



Endnu ingen kommentarer