
Dichlormethan struktur, egenskaber, anvendelser, toksicitet
Det dichlormethan, også kendt som methylenchlorid, det er en organisk forbindelse, hvis kemiske formel er CHtoClto. Specifikt er det et alkylhalogenid afledt af methangas. I modsætning til metan er denne forbindelse en farveløs, polær væske.
Det blev oprindeligt syntetiseret i 1839 af den franske kemiker og fysiker Henri Victor Regnault (1810-1878), der formåede at isolere det fra en blanding af klor og chlormethan udsat for sollys..

Dichlormethan produceres industrielt ved behandling af methan eller chlormethan med chlorgas ved forhøjede temperaturer (400-500 ºC). Sammen med dichlormethan produceres chloroform og carbontetrachlorid i processen, som adskilles ved destillation..
Dichlormethan bruges som opløsningsmiddel, der muliggør svejsning af plastmaterialer og affedtning af metaller. Det bruges også til koffeinfri kaffe og te såvel som en humleekstraktor og fortynder til farvetilsætningsstoffer og blæk til markering af frugt.
Dichlormethan er en giftig forbindelse, der kan forårsage irritation af næsepassager og hals ved indånding. Der er rapporteret om leverskader hos arbejdstagere, der udsættes for høje koncentrationer af dichlormethan. Derudover er det et mutagent middel, der mistænkes for at være kræftfremkaldende.
Artikelindeks
- 1 Struktur
- 2 egenskaber
- 2.1 Udseende
- 2.2 Molær masse
- 2.3 Lugt
- 2.4 Lugttærskel
- 2,5 Massefylde
- 2.6 Smeltepunkt
- 2.7 Kogepunkt
- 2.8 Opløselighed i vand
- 2.9 Opløselighed i andre opløsningsmidler
- 2.10 Octanol / vand fordelingskoefficient
- 2.11 Damptryk
- 2.12 Dampmassefylde
- 2.13 Brydningsindeks (πD)
- 2.14 Viskositet
- 2.15 Flammepunkt
- 2.16 Selvantændelsestemperatur
- 2.17 Stabilitet
- 2.18 Nedbrydning
- 2.19 Korrosion
- 2.20 Fordampningsvarme
- 2.21 Overfladespænding
- 2.22 Reaktivitet
- 3 anvendelser
- 3.1 Fødevareforarbejdning
- 3.2 Farmaceutisk industri
- 3.3 Fotografering
- 3.4 Elektronikindustrien
- 3.5 Malerier
- 3.6 Transport
- 3.7 Andre anvendelser
- 4 Toksicitet
- 4.1 Akutte virkninger
- 4.2 Kroniske virkninger
- 5 Referencer
Struktur
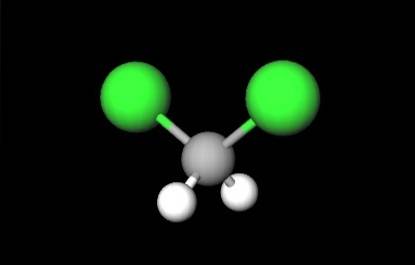
Det første billede viste strukturformlen for CHtoClto, hvor deres kovalente bindinger C-H og C-Cl skiller sig ud. Over den har også sin struktur repræsenteret af en model af kugler og stænger. Bemærk med det blotte øje, at C-H-bindingerne (hvide sfærer) er korte, mens C-Cl-båndene (grønne sfærer) er lange.
CH-geometrientoClto det er tetraeder; men forvrænget af de større kloratomer. Den ene ende af tetraedret er defineret af de to chloratomer, mere elektronegative end hydrogen og carbon. Derfor i CH-molekylettoClto et permanent dipolmoment er etableret (1.6D).
Dette gør det muligt for dichlormethanmolekylerne at interagere med hinanden gennem dipol-dipolkræfter. Ligeledes er disse intermolekylære interaktioner ansvarlige for det faktum, at denne forbindelse eksisterer som en væske på trods af dens lave molekylvægt; en væske, der imidlertid er ret flygtig.
Ejendomme
Udseende
Farveløs væske.
Molar masse
84,93 g / mol.
Lugt
Sød, ligner chloroform.
Lugtgrænse
205 - 307 ppm.
Massefylde
1,3266 g / cm3 (20 ºC).
Smeltepunkt
- 97,6 ºC.
Kogepunkt
39,6 ºC.
Vandopløselighed
25,6 g / L ved 15 ° C og 5,2 g / L ved 60 ° C.
Dichlormethan er næppe opløseligt i vand. Mens begge molekyler, CHtoClto og HtoEller de er polære, deres interaktioner er ineffektive, muligvis på grund af frastød mellem klor- og iltatomer.
Opløselighed i andre opløsningsmidler
Blandbar med ethylacetat, alkohol, hexan, benzen, carbontetrachlorid, diethylether, chloroform og dimethylformamid.
Fordelingskoefficient for oktanol / vand
Log P = 1,19.
Damptryk
57,3 kPa (25 ° C). Dette tryk svarer til ca. 5,66 atm, hvilket afspejler et højt damptryk..
Dampmassefylde
2.93 i forhold til luft taget som 1.
Brydningsindeks (πD)
1.4244 (20 ºC).
Viskositet
0,413 cP (25 ° C).
antændelsespunkt
Dichlormethan er ikke brandfarligt, men når det blandes med luft, dannes det brandfarlige dampe over 100 ° C..
Selvantændelsestemperatur
556 ºC.
Stabilitet
Den er stabil ved omgivelsestemperatur i fravær af fugt og har en relativ stabilitet sammenlignet med dens kongenere: chloroform og carbontetrachlorid..
Det har tendens til at forkulles ved høje temperaturer (300-450 ºC), når dets dampe kommer i kontakt med stål og metalchlorider.
Nedbrydning
Kan nedbrydes ved kontakt med varme overflader eller en flamme og udsender giftige og irriterende dampe af phosgen og hydrogenchlorid..
Korrosion
Dichlormethan angriber nogle former for plast, gummi og belægning.
Fordampningsvarme
28,82 kJ / mol ved 25 ºC.
Overfladespænding
28,20 dyn / cm ved 25 ºC.
Reaktivitet
Dichlormethan reagerer stærkt med aktive metaller, såsom kalium, natrium og lithium. Reagerer med stærke baser, f.eks. Kalium-tert-butoxid. Det er uforeneligt med ætsende stoffer, oxidanter og kemisk aktive metaller.
Derudover reagerer det med flydende ilt i natrium- og kaliumlegeringer og nitrogentetroxid. I kontakt med vand kan det korrodere rustfrit stål, nikkel, kobber såvel som jern.
Ansøgninger
De fleste af anvendelserne og anvendelserne af dichlormethan er baseret på dets egenskaber som opløsningsmiddel. På grund af denne egenskab anvendes dichlormethan i fødevare-, transport-, medicinproduktionsindustrien osv..
Fødevareforarbejdning
Dichlormethan bruges til koffeinfri kaffebønner og teblade. Det bruges også til ekstraktion af humle til øl, drikkevarer og andre aromaer til mad såvel som til forarbejdning af krydderier..
Farmaceutisk industri
Dichlormethan anvendes til fremstilling af cephalosporin og ampicillin ud over fremstilling af antibiotika, steroider og vitaminer.
Fotografering
Det bruges også som opløsningsmiddel i produktionen af cellulosetriacetat (CTA), der anvendes til oprettelse af sikkerhedsfilm.
Elektronisk industri
Det er en ideel forbindelse til produktion af trykte kredsløb, der bruges til at affedt aluminiumsoverfladen, før du tilføjer fotoresistlaget til tavlen.
Maling
Dichlormethan er et opløsningsmiddel, der findes i lakker og malingsudskillere, der bruges til at fjerne lak eller malingsovertræk fra forskellige overfladetyper..
Transportere
Det bruges til at affedt metaldele og overflader, der findes i jernbaneudstyr såvel som i flykomponenter.
Andre anvendelser
Det bruges som sprøjtedrivmiddel (aerosoler) og som et blæsemiddel til polyurethanskum. Det bruges også som væske i nogle typer julelys.
Toksicitet
Akutte effekter
Indånding af dichlormethan kan forårsage irritation i de øvre luftveje, hoste, hvæsen eller åndenød..
Det kan forårsage rødme i huden, og hvis forbindelsen forbliver på den i lang tid, kan det medføre kemiske forbrændinger. I kontakt med øjnene frembringer dichlormethan en alvorlig irritation, der kan strække sig til en forbrænding.
Derudover fungerer det som et neurotoksin, der genererer syns-, auditive og psykomotoriske forstyrrelser; men disse virkninger er reversible, når inhalationen af dichlormethan stoppes.
Kroniske effekter
Dichlormethan kan påvirke centralnervesystemet og forårsage hovedpine, mental forvirring, kvalme, opkastning og hukommelsestab..
Hos dyr producerer det skadelige virkninger på leveren, nyrerne, centralnervesystemet og det kardiovaskulære system.
Med hensyn til kræftfremkaldende egenskaber er der ikke rapporteret om nogen signifikant stigning i kræftdødsfald hos arbejdstagere, der er udsat for dichlormethan. Imidlertid har dyreforsøg vist en stigning, der kan tilskrives dichlormethan, i forekomsten af lever- og lungekræft såvel som godartede tumorer i brystkirtlerne..
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5ta Udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. (10th udgave.). Wiley plus.
- National Center for Biotechnology Information. (2020). Dichlormethan. PubChem Database., CID = 6344. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2020). Dichlormethan. Gendannet fra: en.wikipedia.org
- Brumer. (14. juli 2018). Dichlormethan. Gendannet fra: brumer.com
- MSDS Online. (2019). Dichlormethan (methylenchlorid) Fare- og sikkerhedsoplysninger. Gendannet fra: msdsonline.com
- EPA. (2000). Methylenchlorid (dichlormethan). [PDF]. Gendannet fra: epa.gov



Endnu ingen kommentarer