
Henderson-Hasselbalch ligning forklaring, eksempler, øvelse
Det Henderson-Hasselbalch ligning er et matematisk udtryk, der tillader beregning af pH i en buffer eller bufferopløsning. Det er baseret på syrenes pKa og forholdet mellem koncentrationerne af konjugatbasen eller saltet og syren, der er til stede i bufferopløsningen..
Ligningen blev oprindeligt udviklet af Lawrence Joseph Henderson (1878-1942) i 1907. Denne kemiker etablerede komponenterne i hans ligning baseret på kulsyre som buffer eller buffer..
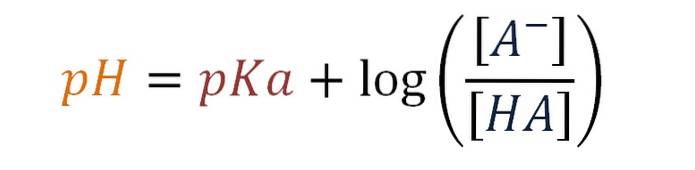
Senere introducerede Karl Albert Hasselbalch (1874-1962) i 1917 brugen af logaritmer som supplement til Henderson-ligningen. Den danske kemiker undersøgte reaktionerne af blod med ilt og effekten på dets pH.
En bufferopløsning er i stand til at minimere de pH-ændringer, som en opløsning gennemgår, ved at tilsætte et volumen stærk syre eller base. Den består af en svag syre og dens stærke konjugatbase, der adskiller sig hurtigt.
Artikelindeks
- 1 Forklaring
- 1.1 Matematisk udvikling
- 1.2 Ligning for en svag base
- 2 Hvordan fungerer en buffer?
- 2.1 Dæmpning
- 2.2 Bufferkapacitet
- 3 Eksempler på Henderson ligninger
- 3.1 Acetatstøddæmper
- 3.2 Kulsyrebuffer
- 3.3 Laktatbuffer
- 3.4 Fosfatbuffer
- 3.5 Oxyhemoglobin
- 3.6 Deoxyhemoglobin
- 4 Løst øvelser
- 4.1 Øvelse 1
- 4.2 Øvelse 2
- 4.3 Øvelse 3
- 5 Referencer
Forklaring
Matematisk udvikling
En svag syre i en vandig opløsning adskiller sig i henhold til loven om masseaktion i henhold til følgende skema:
HA + HtoO ⇌ H+ + TIL-
HA er den svage syre og A.- dens konjugerede base.
Denne reaktion er reversibel og har en ligevægtskonstant (Ka):
Ka = [H+] ·[TIL-] / [HA]
Tager logaritmer:
log Ka = log [H+] + Log [A-] - log [HA]
Hvis hvert udtryk i ligningen multipliceres med (-1), udtrykkes det som følger:
- log Ka = - log [H+] - log [A] + log [HA]
- log Ka er defineret som pKa og - log [H+] er defineret som pH. Efter at have foretaget den korrekte udskiftning reduceres det matematiske udtryk til:
pKa = pH - log [A-] + Log [HA]
Løsning af pH og omgrupperingsudtryk udtrykkes ligningen som følger:
pH = pKa + log [A-] / [HA]
Dette er ligningen Henderson-Hasselbalch for en svag syrebuffer.
Ligning for en svag base
Tilsvarende kan en svag base danne en buffer, og Henderson-Hasselbalch-ligningen for den er som følger:
pOH = pKb + log [HB] / [B-]
Imidlertid stammer de fleste af bufferopløsningerne, selv de af fysiologisk betydning, fra dissociationen af en svag syre. Derfor er det mest anvendte udtryk for Henderson-Hasselbalch-ligningen:
pH = pKa + log [A-] / [HA]
Hvordan fungerer en buffer?
Dæmpning
Henderson-Hasselbalch-ligningen indikerer, at denne opløsning består af en svag syre og en stærk konjugatbase udtrykt som et salt. Denne sammensætning tillader bufferopløsningen at forblive ved en stabil pH, selv når der tilsættes stærke syrer eller baser..
Når der tilsættes en stærk syre til bufferen, reagerer den med den konjugerede base for at danne et salt og vand. Dette neutraliserer syren og tillader pH-variationen at være minimal..
Hvis der nu tilsættes en stærk base til bufferen, reagerer den med den svage syre og danner vand og et salt, hvilket neutraliserer virkningen af den tilsatte base på pH. Derfor er pH-variationen minimal.
PH i en bufferopløsning afhænger af forholdet mellem koncentrationerne af konjugatbasen og den svage syre og ikke af den absolutte værdi af koncentrationerne af disse komponenter. En bufferopløsning kan fortyndes med vand, og pH vil være praktisk talt uændret.
Bufferkapacitet
Bufferkapaciteten afhænger også af pKa af den svage syre såvel som koncentrationerne af den svage syre og konjugatbasen. Jo tættere pH på bufferen er på syrenes pKa, jo større er dens bufferkapacitet..
Jo højere koncentrationen af komponenterne i bufferopløsningen er, jo større er dens bufferkapacitet..
Eksempler på Henderson ligninger
Acetat støddæmper
pH = pKa + log [CH3COO-] / [CH3COOH]
pKa = 4,75
Kulsyrebuffer
pH = pKa + log [HCO3-] / [HtoCO3]
pKa = 6,11
Den samlede proces, der fører til dannelsen af bicarbonationen i en levende organisme, er imidlertid som følger:
COto + HtoO ⇌ HCO3- + H+
At være COto en gas, dens koncentration i opløsning udtrykkes som en funktion af dens partialtryk.
pH = pka + log [HCO3-] / a pCOto
a = 0,03 (mmol / L) / mmHg
pCOto er partialtrykket af COto
Og så ville ligningen se ud som:
pH = pKa + log [HCO3-] / 0,03 pCOto
Laktatbuffer
pH = pKa + log [lactation] / [mælkesyre]
pKa = 3,86
Phosphatbuffer
pH = pKa + log [dibasisk phosphat] / [monobasisk phosphat]
pH = pKa + log [HPO4to-] / [HtoPO4-]
pKa = 6,8
Oxyhemoglobin
pH = pKa + log [HbOto-] / [HHbOto]
pKa = 6,62
Deoxyhemoglobin
pH = pKa + log [Hb-] / HbH
pKa = 8,18
Løst øvelser
Øvelse 1
Fosfatbufferen er vigtig i reguleringen af kroppens pH, da dens pKa (6.8) er tæt på den pH, der findes i kroppen (7.4). Hvad vil være værdien af forholdet [NatoHPO4to-] / [NaHtoPO4-] af Henderson-Hasselbalch-ligningen for en pH-værdi = 7,35 og en pKa = 6,8?
NaH-dissociationsreaktionentoPO4- det er:
NaHtoPO4- (syre) ⇌ NaHPO4to- (base) + H+
pH = pKa + log [NatoHPO4to-] / [NaHtoPO4-]
Løsning af forholdet [konjugat base / syre] for phosphatbufferen har vi:
7,35 - 6,8 = log [NatoHPO4to-] / [NaHtoPO4-]
0,535 = log [NatoHPO4to-] / [NaHtoPO4-]
100,535 = 10log [Na2HPO4] / [NaH2PO4]
3,43 = [NatoHPO4to-] / [NaHtoPO4-]
Øvelse 2
En acetatbuffer har en eddikesyrekoncentration på 0,0135 M og en natriumacetatkoncentration på 0,0260 M. Beregn pH i bufferen, vel vidende at pKa for acetatbufferen er 4,75.
Dissociationsligevægten for eddikesyre er:
CH3COOH ⇌ CH3COO- + H+
pH = pKa + log [CH3COO-] / [CH3COOH]
Udskiftning af de værdier, vi har:
[CH3COO-] / [CH3COOH] = 0,0260 M / 0,0135 M
[CH3COO-] / [CH3COOH] = 1,884
log 1.884 = 0.275
pH = 4,75 + 0,275
pH = 5,025
Øvelse 3
En acetatbuffer indeholder 0,1 M eddikesyre og 0,1 M natriumacetat. Beregn bufferens pH efter tilsætning af 5 ml 0,05 M saltsyre til 10 ml af ovennævnte opløsning.
Det første trin er at beregne den endelige koncentration af HCI, når den blandes med bufferopløsningen:
ViCi = VfCf
Cf = Vi · (Ci / Vf)
= 5 ml · (0,05 M / 15 ml)
= 0,017 M
Saltsyre reagerer med natriumacetat til dannelse af eddikesyre. Derfor falder natriumacetatkoncentrationen med 0,017 M, og koncentrationen af eddikesyre stiger med den samme mængde:
pH = pKa + log (0,1 M - 0,017 M) / (0,1 M + 0,017 M)
pH = pKa + log 0,083 / 0,017
= 4,75 - 0,149
= 4,601
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Jimenez Vargas og J. Mª Macarulla. (1984). Fysiologisk fysisk-kemi. 6. udgave. Redaktionel Interamericana.
- Wikipedia. (2020). Henderson-Hasselbalch ligning. Gendannet fra: en.wikipedia.org
- Gurinder Khaira & Alexander Kot. (5. juni 2019). Henderson-Hasselbalch tilnærmelse. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (29. januar 2020). Henderson Hasselbalch ligningsdefinition. Gendannet fra: thoughtco.com
- Redaktørerne af Encyclopaedia Britannica. (6. februar 2020). Lawrence Joseph Henderson. Encyclopædia Britannica. Gendannet fra: britannica.com


Endnu ingen kommentarer