
Dele og eksempler på kemisk ligning

Det kemisk ligning det er en skematisk gengivelse af nogle af egenskaberne ved en kemisk reaktion. Det kan også siges, at den kemiske ligning beskriver de ændringer, som de forskellige stoffer, der er involveret i en reaktion, oplever.
Formlerne og symbolerne for de forskellige deltagende stoffer placeres i den kemiske ligning, hvilket tydeligt angiver antallet af atomer for hvert element, der er til stede i forbindelserne, som vises som et abonnement og ikke kan ændres ved at balancere ligningen.
Den kemiske ligning skal virke afbalanceret, dvs. at antallet af atomer for både reaktanter og produkter skal være ens. På denne måde overholdes loven om bevarelse af materie. Det er ønskeligt, at de tal, der bruges til at afbalancere ligningerne, er hele tal.
Disse ligninger afslører ikke de på hinanden følgende trin eller ved hvilke mekanismer reaktanterne omdannes til produkter..
Det er derfor, selvom de er meget nyttige til at forstå, hvor en kemisk reaktion går hen, tillader det os ikke at forstå dets molekylære aspekter, eller hvordan det påvirkes af visse variabler; såsom pH, viskositet, reaktionstid, omrøringshastighed, blandt andre.
Artikelindeks
- 1 Dele af en kemisk ligning
- 1.1 Placering af reagenser og produkter
- 1.2 Balancering af kemiske ligninger
- 1.3 Fysiske tilstande for komponenterne i den kemiske ligning
- 1.4 Ændringer i fysisk tilstand
- 2 Eksempel på kemiske ligninger
- 2.1 - Fotosyntese
- 2.2 - Cellular respiration
- 2.3 - Reaktioner af fælles elementer
- 3 Referencer
Dele af en kemisk ligning
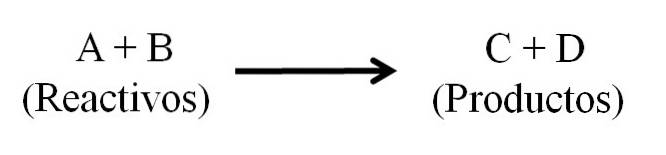
Der er grundlæggende tre hoveddele til en kemisk ligning: reaktanterne, produkterne og pilen, der angiver retningen af den kemiske reaktion..
Placering af reagenser og produkter
Alle stoffer, der fungerer som reaktanter, og alle dem, der er produkter, vises i den kemiske ligning. Disse grupper af stoffer adskilles af en pil, der angiver reaktionens retning. Reagenser er placeret til venstre for pilen og produkter til højre.
Pilen betyder, hvad der produceres og er orienteret fra venstre mod højre (→), selvom der i reversible reaktioner er to ækvivalente og parallelle pile; en rettet mod højre og en til venstre. Symbolet (Δ) er normalt placeret over pilen, hvilket indikerer, at der blev brugt varme i reaktionen..
Desuden placeres identifikationen af katalysatoren normalt på pilen, hvis det er muligt med dens formel eller symbol. De forskellige stoffer, der vises som reaktanter, adskilles af tegnet (+), hvilket indikerer, at stofferne reagerer eller kombineres med hinanden.
I tilfælde af stoffer, der vises som produkter, har tegnet (+) ikke den tidligere konnotation; medmindre reaktionen er reversibel. Det er praktisk, at tegnet (+) placeres lige langt fra de stoffer, det adskiller.
Balancering af kemiske ligninger
Det er et væsentligt krav, at de kemiske ligninger er afbalanceret korrekt. Til dette placeres et tal kaldet den støkiometriske koefficient. Når det er nødvendigt, skal denne koefficient gå før de stoffer, der vises som reaktanter eller produkter..
Dette er for at opnå, at antallet af alle atomer af de elementer, der vises som reaktanter, er nøjagtigt lig med antallet af dem, der vises i produktet. Den enkleste metode til afvejning af kemiske ligninger er forsøg og fejl..
Fysiske tilstande for komponenterne i den kemiske ligning
I nogle kemiske ligninger er stoffernes fysiske tilstand markeret med et abonnement. Til dette anvendes følgende forkortelser på spansk: (s) for fast tilstand; (l) for flydende tilstand (g), gasformig tilstand; og (ac), vandig opløsning.
Eksempel: omsætning af calciumcarbonat med saltsyre.
Tyv3 (r) + 2 HCI(ac) → CaCl2 (r) + HtoELLER(l) + CO2 g)
Ændringer i fysisk tilstand
I nogle tilfælde er det angivet i den kemiske ligning, hvis der dannes en gas i den kemiske reaktion, eller hvis der er udfældning af et eller flere af de producerede stoffer.
Tilstedeværelsen af en gas er angivet med en lodret pil med enden pegende opad (↑), placeret på højre side af det gasformige stof.
Eksempel: omsætning af zink med saltsyre.
Zn + 2 HCI → ZnClto + Hto↑
Hvis et af stofferne i den kemiske reaktion danner et bundfald, symboliseres dette ved at placere en lodret pil med sin ende nedad (↓) placeret på højre side af det udfældede stof..
Eksempel: omsætning af saltsyre med sølvnitrat.
HCI + AgNO3 → HNO3 + AgCl ↓
Eksempel på kemiske ligninger
- Fotosyntese

Fotosyntese er en proces, hvormed planter fanger og transformerer lysenergi, der kommer fra sollys, for at generere den energi, der er nødvendig for deres eksistens. Fotosyntese udføres af nogle organeller af planteceller kaldet kloroplaster.
Thylakoider findes i kloroplastmembranen, steder hvor der findes klorofyler. til Y b, som er de vigtigste pigmenter, der fanger lysenergi.
Selvom fotosyntese er en kompleks proces, kan den skitseres i følgende kemiske ligning:
6 COto + 6 timertoO → C6H12ELLER6 + 6 Oto↑ ΔGº = 2.870 kJ / mol
C6H12ELLER6 Det er formlen for glukose, et kulhydrat, der metaboliseres til produktion af ATP; forbindelse, der er det vigtigste energireservoir i de fleste levende ting. Derudover genereres NADPH fra glucose, et coenzym, der er nødvendigt for mange reaktioner..
- Cellulær respiration
Celler bruger ilt til stofskiftet af adskillige stoffer, der findes i indtaget mad. I mellemtiden bruges ATP som en energikilde til de aktiviteter, der udføres af levende væsener, der producerer kuldioxid og vand i disse processer..
Hvis glukose bruges som en model for et metaboliseret stof, kan respiration skematiseres ved hjælp af følgende kemiske ligning:
C6H12ELLER6 + 6 Oto → 6 COto + 6 timertoELLER
- Almindelige elementreaktioner
Nedbrydningsreaktion
En forbindelse eller forbindelser adskiller sig og danner andre forskellige forbindelser med deres atomer:
2 KClO3 (r) → 2 KCl(s) + 3 O2 g)
Forskydningsreaktion
Et metal reagerer med en forbindelse, der erstatter et metal, der er til stede i det:
Mg(s) + RUTE4 (ac) → Cu(s) + MgSO4 (ac)
Elimineringsreaktion
I denne type reaktion falder antallet af atomer eller grupper knyttet til et carbonatom:
CH3-CHtoBr + NaOH → HtoC = CHto + HtoO + NaBr
Hydreringsreaktion
Det er en reaktion, hvor en forbindelse tilføjer et vandmolekyle. Denne reaktion er vigtig ved fremstillingen af alkoholer:
HtoC = CHto + HtoO → HtoC-CHtoÅh
Neutraliseringsreaktion
En base eller alkali reagerer med en syre, der producerer et salt og vand:
HCI(ac) + NaOH(ac) → NaCl(ac) + HtoELLER(l)
Syntese reaktion
I denne type reaktion kombineres to eller flere stoffer for at skabe en ny forbindelse:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Dobbelt forskydningsreaktion (metatese)
I denne type reaktion er der udveksling af positive og negative ioner til dannelse af nye forbindelser:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Storebror3 (ac)
Referencer
- Flores, J. (2002). Kemi. Udgave 1det var. Redaktionel Santillana
- Mathews, C. K., Van Holde, K. E. og Ahern, K. G. (2002). Biokemi. 3det var Udgave. Udgiver Pearson Addison Wesley
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2019). Kemisk ligning. Gendannet fra: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20. september 2019). Hvad er en kemisk ligning? Gendannet fra: thoughtco.com



Endnu ingen kommentarer