
Elektronegativitetsskalaer, variation, nytte og eksempler

Det elektronegativitet det er en relativ periodisk egenskab, der vedrører et atoms evne til at tiltrække elektrondensitet fra dets molekylære miljø. Det er et atoms tendens til at tiltrække elektroner, når det er knyttet til et molekyle. Dette afspejles i adfærden for mange forbindelser og i, hvordan de interagerer intermolekylært med hinanden..
Ikke alle elementer tiltrækker elektroner fra tilstødende atomer i samme grad. I tilfælde af dem, der let giver elektrondensitet, siges det at de er elektropositive, mens de der er "dækket" med elektroner er elektronegativ. Der er mange måder at forklare og observere denne egenskab (eller koncept).
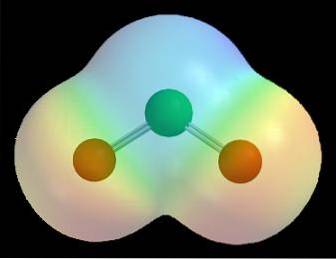
For eksempel i elektrostatiske kort over et molekyle (som det for chlordioxid i billedet ovenfor, ClOto) virkningen af de forskellige elektronegativiteter for klor- og iltatomer observeres.
Den røde farve angiver de elektronrige regioner i molekylet, δ-, og den blå farve angiver de elektronfattige regioner, δ +. Efter en række beregningsberegninger kan denne type kort således etableres; mange af dem viser et direkte forhold mellem placeringen af elektronegative atomer og δ-.
Det kan også visualiseres som følger: inden for et molekyle er det mere sandsynligt, at transit af elektroner forekommer i nærheden af de mest elektronegative atomer. Det er af denne grund, at for ClOto iltatomerne (de røde kugler) er omgivet af en rød sky, mens kloratomet (den grønne kugle) er omgivet af en blålig sky.
Definitionen af elektronegativitet afhænger af den tilgang, der gives til fænomenet, der er flere skalaer, der betragter det fra visse aspekter. Imidlertid har alle skalaer til fælles, at de understøttes af atommers iboende natur.
Artikelindeks
- 1 Elektronegativitetsskalaer
- 1.1 Pauling-skala
- 1.2 Mulliken skala
- 1.3 Skala af A.L. Allred og E. Rochow
- 2 Hvordan varierer elektronegativitet i det periodiske system?
- 2.1 Atomet i molekylet
- 3 Hvad er det til??
- 4 eksempler (klor, ilt, natrium, fluor)
- 5 Referencer
Elektronegativitetsskalaer
Elektronegativitet er ikke en egenskab, der kan kvantificeres, og den har heller ikke absolutte værdier. Hvorfor? Fordi et atoms tendens til at tiltrække elektrondensitet mod det ikke er den samme i alle forbindelser. Med andre ord: elektronegativitet varierer afhængigt af molekylet.
Ja for ClO-molekyletto Hvis Cl-atomet blev udskiftet med N-atomet, ville tendensen til O til at tiltrække elektroner også ændre sig; det kan stige (gøre skyen rødere) eller falde (miste farve). Forskellen ville ligge i den dannede nye N-O-binding for således at have O-N-O-molekylet (nitrogendioxid, NOto).
Da et atoms elektronegativitet ikke er den samme i alle dens molekylære omgivelser, er det nødvendigt at definere det med andre variabler. På denne måde er der værdier, der tjener som en reference, og som tillader forudsigelse af for eksempel den type binding, der dannes (ionisk eller kovalent).
Pauling skala
Den store videnskabsmand og vinder af to nobelpriser, Linus Pauling, foreslog i 1932 en kvantitativ (målbar) form af elektronegativet kendt som Pauling-skalaen. I den var elektronegativiteten af to grundstoffer, A og B, der dannede bindinger, relateret til den ekstra energi forbundet med den ioniske karakter af bindingen A-B.
Hvordan er dette? Teoretisk er kovalente bindinger de mest stabile, da fordelingen af deres elektroner mellem to atomer er retfærdig; for molekyler A-A og B-B deler begge atomer båndets elektroner på samme måde. Men hvis A er mere elektronegativ, vil parret være mere A end B.
I så fald er A-B ikke længere fuldstændigt kovalent, selvom hvis deres elektronegativiteter ikke adskiller sig meget, kan det siges, at deres binding har en høj kovalent karakter. Når dette sker, gennemgår bindingen en lille ustabilitet og erhverver ekstra energi som et produkt af elektronegativitetsforskellen mellem A og B.
Jo større denne forskel er, desto større er energien i A-B-bindingen og følgelig jo større er den ioniske karakter af nævnte binding..
Denne skala repræsenterer den mest anvendte i kemi, og elektronegativitetsværdierne opstod fra tildelingen af en værdi på 4 for fluoratomet. Derfra kunne de beregne det for de andre elementer.
Mulliken skala
Mens Pauling-skalaen har at gøre med energien forbundet med bindingerne, er Robert Mulliken-skalaen mere relateret til to andre periodiske egenskaber: ioniseringsenergi (EI) og elektronaffinitet (AE).
Således er et element med høje EI- og AE-værdier meget elektronegative og vil derfor tiltrække elektroner fra dets molekylære miljø..
Hvorfor? Fordi EI afspejler, hvor svært det er at "rive" en ekstern elektron fra den, og AE hvor stabil er den anion, der dannes i gasfasen. Hvis begge egenskaber har store størrelser, er elementet "elsker" af elektroner..
Mulliken-elektronegativiteterne beregnes med følgende formel:
ΧM = ½ (EI + AE)
Det vil sige χM svarer til gennemsnitsværdien af EI og AE.
I modsætning til Pauling-skalaen, der afhænger af hvilke atomer der danner bindinger, er den imidlertid relateret til valenstilstandens egenskaber (med dens mest stabile elektroniske konfigurationer).
Begge skalaer genererer ens elektronegativitetsværdier for elementerne og er omtrent relateret til følgende rekonvertering:
ΧP = 1,35 (ΧM)1/2 - 1.37
Begge XM som XP de er dimensionsløse værdier; de mangler enheder.
Skala af A.L. Allred og E. Rochow
Der er andre elektronegativitetsskalaer, såsom Sanderson- og Allen-skalaen. Men den, der følger de første to, er Allred og Rochow skalaen (χAR). Denne gang er det baseret på den effektive nukleare ladning, som en elektron oplever på overfladen af atomer. Derfor er det direkte relateret til kernens attraktive styrke og skærmeffekten..
Hvordan varierer elektronegativitet i det periodiske system?
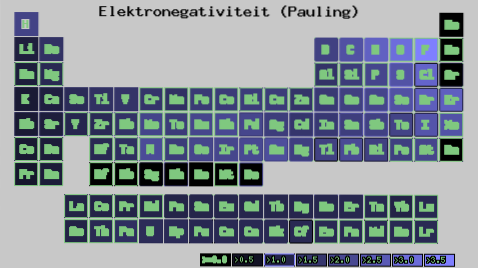
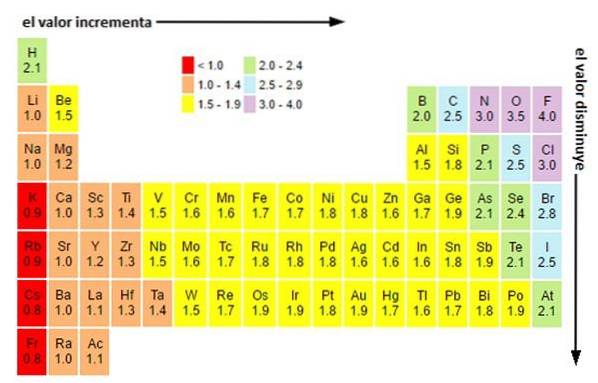
Uanset skalaer eller værdier, du har, stiger elektronegativiteten fra højre til venstre i en periode og fra bund til top i grupperne. Således stiger den mod den øverste højre diagonal (ikke medregnet helium), indtil den møder fluor.
På billedet ovenfor kan du se, hvad der lige er blevet sagt. I det periodiske system udtrykkes Pauling-elektronegativiteterne som en funktion af cellernes farver. Da fluor er den mest elektronegative, har den en mere fremtrædende lilla farve, mens den mindst elektronegative (eller elektropositive) mørkere farver..
Ligeledes kan det observeres, at lederne af grupper (H, Be, B, C osv.) Har lysere farver, og at når man kommer ned gennem gruppen, bliver de andre elementer mørkere. Hvad drejer det sig om? Svaret er igen både i egenskaberne EI, AE, Zef (effektiv nuklear ladning) og i atomradien.
Atomet i molekylet
De enkelte atomer har en reel nuklear ladning Z, og de eksterne elektroner lider under en effektiv nuklear ladning som et resultat af afskærmningseffekten..
Når det bevæger sig over en periode, stiger Zef på en sådan måde, at atomet trækker sig sammen; Atomeradierne reduceres over en periode.
Dette har den konsekvens, at elektronerne i øjeblikket binder et atom med et andet, "strømmer" mod atomet med det højeste Zef. Dette giver også en ionisk karakter til bindingen, hvis der er en markant tendens til, at elektroner går mod et atom. Når dette ikke er tilfældet, taler vi om en overvejende kovalent binding.
Af denne grund varierer elektronegativiteten i henhold til atomradierne, Zef, som igen er tæt beslægtet med EI og AE. Alt er en kæde.
Hvad er det for?
Hvad er elektronegativitet til? I princippet at bestemme, om en binær forbindelse er kovalent eller ionisk. Når elektronegativitetsforskellen er meget høj (med en hastighed på 1,7 enheder eller mere) siges forbindelsen at være ionisk. Det er også nyttigt at skelne i en struktur, hvilke regioner der sandsynligvis er rigere på elektroner..
Herfra kan forudsiges hvilken mekanisme eller reaktion forbindelsen kan gennemgå. I elektronfattige regioner, δ +, kan negativt ladede arter virke på en bestemt måde; og i elektronrige regioner kan deres atomer interagere på meget specifikke måder med andre molekyler (dipol-dipol-interaktioner).
Eksempler (klor, ilt, natrium, fluor)
Hvad er elektronegativitetsværdierne for klor-, ilt-, natrium- og fluoratomer? Hvem er den mest elektronegative efter fluor? Ved hjælp af det periodiske system observeres det, at natrium har en mørk lilla farve, mens farverne for ilt og klor er visuelt meget ens..
Dens elektronegativitetsværdier for skalaerne Pauling, Mulliken og Allred-Rochow er:
Na (0,93, 1,21, 1,01).
Eller (3.44, 3.22, 3.50).
Cl (3,16, 3,54, 2,83).
F (3,98, 4,43, 4,10).
Bemærk, at der med de numeriske værdier observeres en forskel mellem negativiteten af ilt og klor.
Ifølge Mulliken-skalaen er klor mere elektronegativ end ilt i modsætning til Pauling- og Allred-Rochow-skalaen. Elektronegativitetsforskellen mellem de to elementer er endnu mere tydelig ved hjælp af Allred-Rochow-skalaen. Og endelig er fluor uanset den valgte skala den mest elektronegative..
Derfor, hvor der er et F-atom i et molekyle, betyder det, at bindingen vil have en høj ionisk karakter..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave., Side 30 og 44). Mc Graw Hill.
- Jim Clark. (2000). Elektronegativitet. Hentet fra: chemguide.co.uk
- Anne Marie Helmenstine, Ph.D. (11. december 2017). Elektronegativitetsdefinition og eksempler. Hentet fra: thoughtco.com
- Mark E. Tuckerman. (5. november 2011). Elektronegativitetsskala. Hentet fra: nyu.edu
- Wikipedia. (2018). Elektronegativitet. Hentet fra: es.wikipedia.org


Endnu ingen kommentarer