
Crystal Structure Structure, Typer og eksempler
Det krystalstruktur Det er en af de faste stater, som atomer, ioner eller molekyler kan optage i naturen, hvilket er karakteriseret ved at have en høj rumlig orden. Med andre ord er dette bevis for den "korpuskulære arkitektur", der definerer mange kroppe med glasagtige og skinnende udseende..
Hvad fremmer eller hvilken kraft er ansvarlig for denne symmetri? Partiklerne er ikke alene, men de interagerer med hinanden. Disse interaktioner forbruger energi og påvirker stabiliteten af de faste stoffer, så partiklerne søger at imødekomme sig selv for at minimere dette energitab..

Så deres iboende natur fører dem til at placere sig i det mest stabile rumlige arrangement. For eksempel kan dette være den, hvor frastødningerne mellem ioner med de samme ladninger er minimale, eller hvor nogle atomer - som metalliske - også optager det størst mulige volumen i deres pakninger..
Ordet "krystal" har en kemisk betydning, der kan blive gengivet forkert for andre kroppe. Kemisk henviser det til en ordnet struktur (mikroskopisk), som for eksempel kan bestå af DNA-molekyler (en DNA-krystal).
Imidlertid er det populært misbrugt at henvise til enhver glasagtig genstand eller overflade, såsom spejle eller flasker. I modsætning til ægte krystaller består glas af en amorf (uordnet) struktur af silicater og mange andre additiver..
Artikelindeks
- 1 Struktur
- 1.1 Enhedscelle
- 2 slags
- 2.1 I henhold til dets krystallinske system
- 2.2 I henhold til dets kemiske natur
- 3 eksempler
- 3.1 K2Cr2O7 (triklinik-system)
- 3.2 NaCl (kubisk system)
- 3.3 ZnS (wurtzit, sekskantet system)
- 3.4 CuO (monoklinisk system)
- 4 Referencer
Struktur
På billedet ovenfor er nogle smaragdperler illustreret. Ligesom disse udviser mange andre mineraler, salte, metaller, legeringer og diamanter en krystallinsk struktur; men hvilket forhold har dets ordning med symmetrien?
Hvis en krystal, hvis partikler kunne observeres med det blotte øje, påføres symmetrioperationer (vende den, dreje den i forskellige vinkler, reflektere den i et plan osv.), Vil det blive fundet, at den forbliver intakt i alle dimensioner af rummet..
Det modsatte forekommer for et amorft fast stof, hvorfra forskellige ordrer opnås ved at udsætte det for en symmetrioperation. Derudover mangler det strukturelle gentagelsesmønstre, som viser tilfældigheden i fordelingen af dets partikler..
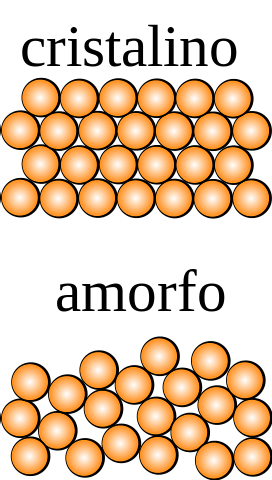
Hvad er den mindste enhed, der udgør det strukturelle mønster? På det øverste billede er det krystallinske faste stof symmetrisk i rummet, mens det amorfe ikke er det..
Hvis der blev tegnet firkanter, der blev lukket orange kugler og symmetrioperationer på dem, ville det konstateres, at de genererer andre dele af krystallen.
Ovenstående gentages med mindre og mindre firkanter, indtil man finder den asymmetriske; den, der går foran den i størrelse, er pr. definition enhedscellen.
Enhedscelle
Enhedscellen er det mindste strukturelle udtryk, der muliggør fuldstændig reproduktion af det krystallinske faste stof. Ud fra dette er det muligt at samle glasset og flytte det i alle retninger af rummet.
Det kan betragtes som en lille skuffe (bagagerum, spand, beholder osv.), Hvor partiklerne, repræsenteret af kugler, placeres efter et påfyldningsmønster. Dimensionerne og geometrien i denne kasse afhænger af længderne på dens akser (a, b og c) samt vinklerne imellem dem (α, β og γ).
Den enkleste af alle enhedsceller er den af den enkle kubiske struktur (øverste billede (1)). I dette optager midten af kuglerne hjørnerne på terningen, fire i bunden og fire i loftet..
I dette arrangement optager kuglerne kun 52% af kubens samlede volumen, og da naturen afskyr et vakuum, vedtager ikke mange forbindelser eller elementer denne struktur..
Men hvis kuglerne er arrangeret i den samme terning på en sådan måde, at man optager midten (kubisk centreret i kroppen, bcc), vil der være en mere kompakt og effektiv pakning (2). Nu optager kuglerne 68% af det samlede volumen.
På den anden side i (3) indtager ingen kugle centrum af terningen, men midten af dens ansigter, og de optager alle op til 74% af det samlede volumen (ansigt-centreret kubisk, cc).
Således kan det ses, at der til den samme terning kan opnås andre arrangementer, der varierer den måde, hvorpå kuglerne pakkes (ioner, molekyler, atomer osv.).
Typer
Krystalstrukturer kan klassificeres efter deres krystalsystemer eller den kemiske natur af deres partikler..
For eksempel er det kubiske system det mest almindelige af alle, og mange krystallinske faste stoffer styres af det; Imidlertid gælder det samme system for både ioniske og metalliske krystaller..
I henhold til dets krystallinske system
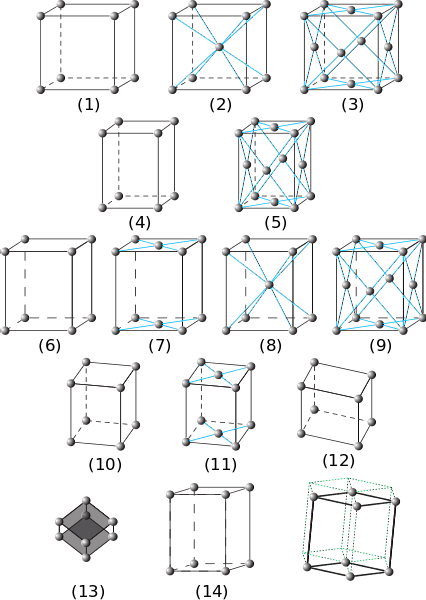
I det forrige billede er de syv hovedkrystallsystemer repræsenteret. Det kan bemærkes, at der faktisk er fjorten af disse, som er produktet af andre former for emballage til de samme systemer og udgør Bravais-netværk.
Fra (1) til (3) er krystaller med kubiske krystalsystemer. I (2) observeres det (ved de blå striber), at kuglen i midten og hjørnerne interagerer med otte naboer, så kuglerne har et koordinationsnummer på 8. Og i (3) er koordinationstallet 12 ( for at se det skal du duplikere terningen i enhver retning).
Elementerne (4) og (5) svarer til enkle og ansigtscentrerede tetragonale systemer. I modsætning til kubikken er dens c-akse længere end a- og b-akserne.
Fra (6) til (9) er de orthorhombiske systemer: fra det enkle og centreret på baserne (7) til dem centreret på kroppen og ansigterne. I disse α er β og γ 90º, men alle sider har forskellige længder.
Figurerne (10) og (11) er de monokliniske krystaller, og (12) er den trikliniske, den sidste præsenterer uligheder i alle dens vinkler og akser..
Element (13) er det rombohedriske system, analogt med det kubiske, men med en vinkel γ forskellig fra 90 °. Endelig er der de sekskantede krystaller
Forskydningerne af elementerne (14) stammer fra det sekskantede prisme, der er sporet af de grønne stiplede linjer.
I henhold til dets kemiske natur
- Hvis krystallerne består af ioner, er de ioniske krystaller til stede i salte (NaCl, CaSO4, CuClto, KBr osv.)
- Molekyler som glukose danner (når som helst de kan) molekylære krystaller; i dette tilfælde de berømte sukkerkrystaller.
- Atomer, hvis bindinger i det væsentlige er kovalente, danner kovalente krystaller. Sådan er tilfældene med diamant eller siliciumcarbid.
- Metaller såsom guld danner også kompakte kubiske strukturer, som udgør metalliske krystaller..
Eksempler
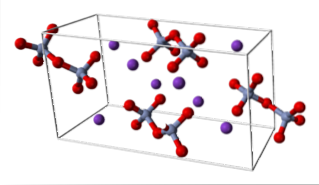
KtoCrtoELLER7 (trikliniksystem)
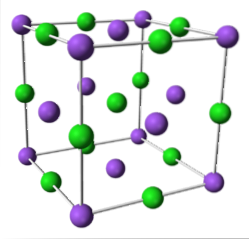
NaCl (kubisk system)
ZnS (wurtzit, sekskantet system)
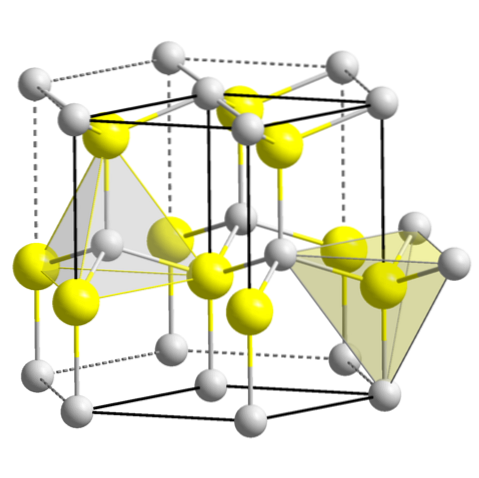
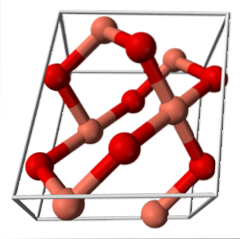
CuO (monoklinisk system)
Referencer
- Quimitube. (2015). Hvorfor "krystaller" ikke er krystaller. Hentet den 24. maj 2018 fra: quimitube.com
- Pressebøger. 10.6 Gitterstrukturer i krystallinske faste stoffer. Hentet den 26. maj 2018 fra: opentextbc.ca
- Crystal Structures Academic Resource Center. [PDF]. Hentet den 24. maj 2018 fra: web.iit.edu
- Ming. (30. juni 2015). Typer Krystalstrukturer. Hentet den 26. maj 2018 fra: crystalvisions-film.com
- Helmenstine, Anne Marie, Ph.D. (31. januar 2018). Typer af krystaller. Hentet den 26. maj 2018 fra: thoughtco.com
- KHI. (2007). Krystallinske strukturer. Hentet den 26. maj 2018 fra: folk.ntnu.no
- Paweł Maliszczak. (25. april 2016). Grove smaragdkrystaller fra Panjshir Valley Afghanistan. [Figur]. Hentet den 24. maj 2018 fra: commons.wikimedia.org
- Napy1kenobi. (26. april 2008). Bravais gitter. [Figur]. Hentet den 26. maj 2018 fra: commons.wikimedia.org
- Bruger: Sbyrnes321. (21. november 2011). Krystallinsk eller amorf. [Figur]. Hentet den 26. maj 2018 fra: commons.wikimedia.org



Endnu ingen kommentarer