
Kvartær struktur af karakteristiske proteiner
Det kvaternær struktur af proteiner definerer de rumlige forhold mellem hver af dets polypeptidsubenheder forbundet med ikke-kovalente kræfter. I polymere proteiner kaldes hver af de polypeptidkæder, der udgør den, underenheder eller protomerer.
Proteiner kan bestå af en (monomer), to (dimer), flere (oligomere) eller mange protomerer (polymere). Disse protomerer kan have en lignende eller meget forskellig molekylær struktur. I det første tilfælde siges de at være homotypiske proteiner og i det andet tilfælde heterotypiske.
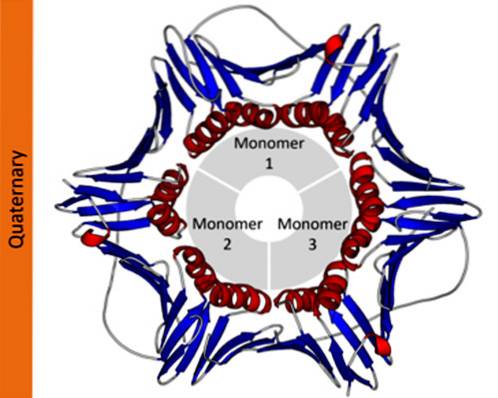
I videnskabelig notation bruger biokemikere græske bogstaver til at beskrive protomersammensætningen af proteiner. For eksempel betegnes et tetramert homotypisk protein som a4, mens et tetramert protein, der består af to forskellige dimerer, betegnes som atoβto.
Artikelindeks
- 1 Proteinstruktur
- 1.1 Primær struktur
- 1.2 Sekundær struktur
- 1.3 Tertiær struktur
- 1.4 Kvartær struktur
- 2 Stabilitet i den kvaternære struktur
- 2.1 Hydrofobe interaktioner
- 2.2 Van der Waals-interaktioner
- 2.3 Load-load interaktioner
- 2.4 Brintbindinger
- 2.5 Interaktioner mellem dipoler
- 3 Interaktioner mellem protomerer
- 3.1 Homotypiske interaktioner
- 3.2 Heterotypiske interaktioner
- 4 Referencer
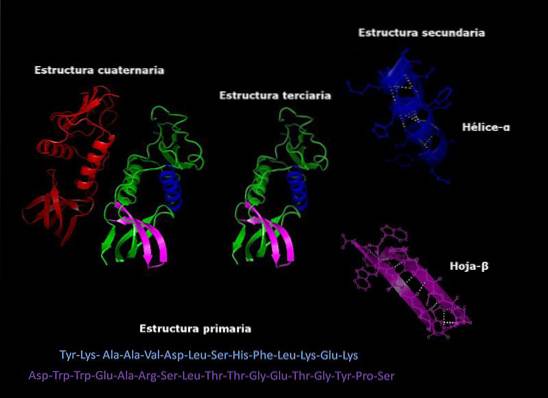
Proteinstruktur
Proteiner er komplekse molekyler, der påtager sig forskellige tredimensionelle konfigurationer. Disse konfigurationer er unikke for hvert protein og giver dem mulighed for at udføre meget specifikke funktioner. Niveauerne for strukturel organisering af proteiner er som følger.
Primær struktur
Det refererer til den sekvens, i hvilken de forskellige aminosyrer er arrangeret i polypeptidkæden. Denne sekvens er givet af DNA-sekvensen, der koder for proteinet.
Sekundær struktur
De fleste proteiner er ikke fuldt udstrakte lange kæder af aminosyrer, men har snarere regioner, der regelmæssigt foldes i helixer eller ark. Denne foldning er den, der modtager navnet på den sekundære struktur.
Tertiær struktur
De foldede områder af den sekundære struktur kan igen foldes og samles til mere kompakte strukturer. Denne sidste fold er det, der giver proteinet sin tredimensionelle form..
Kvartær struktur
I proteiner, der består af mere end en underenhed, er de kvaternære strukturer de rumlige forhold, der findes mellem hver underenhed, som er forbundet med ikke-kovalente bindinger..
Kvaternær strukturstabilitet
Den tredimensionelle struktur af proteiner stabiliseres ved svage eller ikke-kovalente interaktioner. Mens disse bindinger eller interaktioner er meget svagere end normale kovalente bindinger, er de mange, og deres kumulative effekt er stærk. Her vil vi se nogle af de mest almindelige interaktioner.
Hydrofobe interaktioner
Nogle aminosyrer indeholder hydrofobe sidekæder. Når proteiner har disse aminosyrer, ordner foldningen af molekylet disse sidekæder mod det indre af proteinet og beskytter dem mod vand. Naturen af de forskellige sidekæder betyder, at de bidrager på forskellige måder til den hydrofobe effekt..
Van der Waals-interaktioner
Disse interaktioner opstår, når molekyler eller atomer, der ikke er bundet af kovalente bindinger, kommer for tæt på hinanden, og derfor begynder deres yderste elektroniske orbitaler at overlappe hinanden..
I det øjeblik etableres en frastødende kraft mellem disse atomer, der vokser meget hurtigt, når deres respektive centre nærmer sig. Dette er de såkaldte "van der Waals styrker".
Load-load interaktioner
Det er den elektrostatiske interaktion, der opstår mellem et par ladede partikler. I proteiner forekommer denne type interaktion både på grund af proteinets nettoladning og den individuelle ladning af ionerne indeholdt i det. Denne type interaktion kaldes undertiden en saltbro..
Brintbindinger
En hydrogenbinding etableres mellem et hydrogenatom kovalent bundet til en hydrogenbinding-donorgruppe og et par frie elektroner, der tilhører en bindingsacceptorgruppe.
Denne type binding er meget vigtig, da egenskaberne for mange molekyler, inklusive vand og biologiske molekyler, i vid udstrækning skyldes hydrogenbindinger. Den deler egenskaber ved kovalente bindinger (elektroner deles) og også af ikke-kovalente interaktioner (charge-charge interaktion).
Dipole interaktioner
I molekyler, herunder proteiner, der ikke udgør en nettoladning, kan der forekomme et ikke-ensartet arrangement af deres interne ladninger, hvor den ene ekstremitet er lidt mere negativ end den anden. Dette er hvad der er kendt som en dipol.
Denne dipolære tilstand i molekylet kan være permanent, men den kan også induceres. Dipoles kan tiltrækkes af ioner eller andre dipoler. Hvis dipolerne er permanente, har interaktionen et større omfang end det, der forekommer med inducerede dipoler.
Ud over disse ikke-kovalente interaktioner stabiliserer nogle oligomere proteiner deres kvaternære struktur gennem en type kovalent binding, disulfidbindingen. Disse etableres mellem sulfhydrylgrupperne i cysteinerne fra forskellige protomerer.
Disulfidbindinger hjælper også med at stabilisere den sekundære struktur af proteiner, men i dette tilfælde forbinder de cysteinylrester inden for det samme polypeptid (intrapolypeptiddisulfidbindinger)..
Interaktioner mellem protomerer
Som nævnt ovenfor kan disse underenheder i proteiner, der består af flere underenheder eller protomerer, være ens (homotypiske) eller forskellige (heterotypiske)..
Homotypiske interaktioner
Underenhederne, der udgør et protein, er asymmetriske polypeptidkæder. I homotypiske interaktioner kan disse underenheder imidlertid associeres på forskellige måder og opnå forskellige typer symmetri..
De interagerende grupper i hver protomer er generelt placeret i forskellige positioner, hvorfor de kaldes heterologe interaktioner. Heterologe interaktioner mellem de forskellige underenheder forekommer undertiden på en sådan måde, at hver underenhed er snoet i forhold til den foregående og er i stand til at opnå en spiralformet struktur.
Ved andre lejligheder opstår interaktionerne på en sådan måde, at definerede grupper af underenheder er arrangeret omkring en eller flere symmetriakser, i det der kaldes punktgruppesymmetri. Når der er flere symmetriakser, roterer hver underenhed i forhold til sin nabo 360 ° / n (hvor n repræsenterer antallet af akser).
Blandt de typer symmetri, der opnås på denne måde, er for eksempel spiralformet, kubisk og icosahedral.
Når to underenheder interagerer gennem en binær akse, roterer hver enhed 180 ° i forhold til den anden omkring den akse. Denne symmetri er kendt som C-symmetrito. I det er interaktionsstederne i hver underenhed identiske; i dette tilfælde taler vi ikke om en heterolog interaktion, men en isolog interaktion.
Hvis derimod forbindelsen mellem de to komponenter i dimeren er heterolog, opnås der en asymmetrisk dimer.
Heterotypiske interaktioner
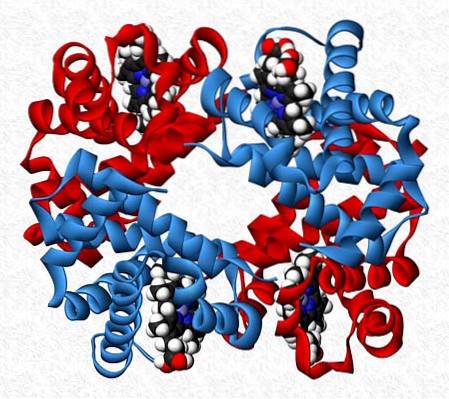
De interagerende underenheder i et protein er ikke altid af samme art. Der er proteiner, der består af tolv eller flere forskellige underenheder.
Interaktionerne, der opretholder proteinets stabilitet, er de samme som i homotypiske interaktioner, men der opnås generelt asymmetriske molekyler..
Hæmoglobin er for eksempel en tetramer, der har to par forskellige underenheder (αtoβto).
Referencer
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biokemi. 3. udgave. Benjamin / Cummings Publishing Company, Inc.
- R.K. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemestry. Appleton & Lange
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biokemi. 5. udgave. W. H. Freeman og Company.
- J. Koolman & K.-H. Roehm (2005). Farveatlas for biokemi. 2. udgave. Thieme.
- A. Lehninger (1978). Biokemi. Ediciones Omega, S.A.
- L. Stryer (1995). Biokemi. W H. Freeman and Company, New York.



Endnu ingen kommentarer