
Tertiær struktur af de vigtigste karakteristiske proteiner
Det proteinernes tertiære struktur Det er den tredimensionale konformation, som polypeptidkæder erhverver, når de foldes på sig selv. Denne konformation vises ved vekselvirkninger mellem sidekæderne af aminosyreresterne i polypeptidet. Sidekæder kan interagere uanset deres position i proteinet.
Fordi det afhænger af interaktionerne mellem R-grupperne, viser den tertiære struktur ikke-gentagne aspekter af kæden, da disse grupper er forskellige for hver aminosyrerest. Den sekundære struktur afhænger derimod af carboxyl- og aminogrupperne, som er til stede i alle aminosyrer.
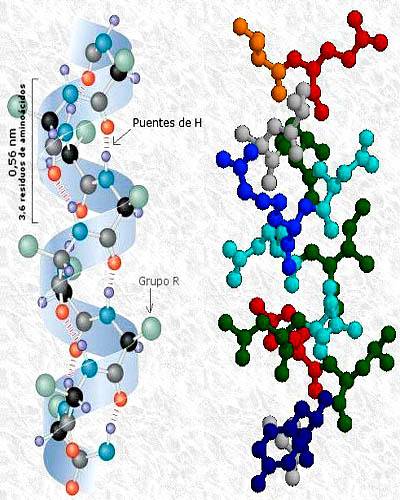
Tertiær struktur af proteinkinase-phosphatase med sekundære strukturer i alfa-helix og beta-ark. Taget og redigeret fra: A2-33. Modificeret af Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Nogle forfattere antyder, at fibrøse proteiner har en simpel tertiær struktur, men ikke desto mindre påpeger andre forfattere, at denne struktur er typisk for kugleformede proteiner..
Artikelindeks
- 1 Fiberholdige proteiner
- 1.1 α-keratiner
- 1.2 β-keratiner
- 1.3 Kollagen
- 1.4 Andre fibrøse proteiner
- 2 kugleformede proteiner
- 2.1 Karakteristika for den tertiære struktur af kugleformede proteiner
- 2.2 Generelle regler for foldning af kugleformede proteiner
- 3 Proteindenaturering
- 4 Referencer
Fibre proteiner
I fibrøse proteiner er polypeptidkæderne arrangeret i form af lange filamenter eller lange ark; de består generelt af en enkelt type sekundær struktur. Denne sekundære struktur er i de fleste tilfælde vigtigere end den tertiære struktur til bestemmelse af proteinets form..
Dens biologiske funktion er strukturel, hvilket giver organer og strukturer, hvor de findes styrke og / eller elasticitet, mens den holdes sammen. Alle fibrøse proteiner er uopløselige i vand på grund af den store mængde hydrofobe aminosyrerester, de præsenterer.
Disse fibrøse proteiner inkluderer keratiner og kollagen. Førstnævnte findes i bindevæv og i strukturer som hår, negle (α-keratiner), skalaer og fjer (β-keratiner). Kollagen findes på sin side blandt andet i knogler, sener og hud.
α-keratiner
Disse proteiner er en del af de såkaldte mellemliggende filamentproteiner, som spiller en vigtig rolle i cytoskelettet hos flercellede organismer. Derudover er de den vigtigste bestanddel af hår, negle, uld, horn, hove og et af de vigtigste proteiner i dyrehud..
Molekylets struktur er en α-helix. To α-keratin-tråde kan arrangeres parallelt og vikles hinanden med deres hydrofobe R-grupper, der interagerer med hinanden. På denne måde oprettes en superhelisk struktur eller kugle med en venstre vikling..
Den tertiære struktur af α-keratin er enkel og domineres af den sekundære struktur af α-helix. På den anden side er den kvaternære struktur også til stede, da to molekyler deltager i den superheliske struktur, som interagerer gennem ikke-kovalente bindinger..
β-keratiner
Den primære struktur svarer til den for α-keratiner, men deres sekundære struktur er domineret af β-ark. De er den vigtigste bestanddel af krybdyrskalaer og fuglefjer..
Kollagen
Dette protein kan repræsentere mere end 30% af den samlede proteinmasse for nogle dyr. Findes i brusk, knogler, sener, hornhinde og hud, blandt andre væv.
Den sekundære struktur af kollagen er unik og repræsenteres af en venstrehåndet helix med 3,3 aminosyrerester for hver tur. Tre venstrehåndede helixkæder (α-kæder) vikles rundt om hinanden, hvilket giver et højrehåndet supercoiled molekyle, kendt af nogle forfattere som tropokollagen..
Tropokollagenmolekyler samles for at danne en kollagenfiber, der har en høj styrke, bedre end stål og sammenlignelig med den af kobber med høj styrke.
Andre fibrøse proteiner
Andre typer fibrøse proteiner er fibroin og elastin. Den første består af β-ark, der hovedsageligt består af glycin, alanin og serin..
Sidekæderne af disse aminosyrer er små i størrelse, så de kan pakkes tæt. Resultatet er en fiber, der både er meget modstandsdygtig og meget lidt udvidelig..
I elastin erstatter valin på sin side serin blandt dets vigtigste aminosyrer. I modsætning til fibroin er elastin meget udvidelig, deraf navnet. I molekylets sammensætning virker lysin også, som kan deltage i tværbindinger, der gør det muligt for elastin at genvinde sin form, når spændingen ophører.
Globulære proteiner
Globulære proteiner, i modsætning til fibrøse, er opløselige og har generelt flere typer sekundære strukturer. Imidlertid er de tredimensionelle konformationer, som de får, når de foldes på sig selv, vigtigere (tertiær struktur).
Disse særlige tredimensionelle konformationer giver hvert protein specifik biologisk aktivitet. Hovedfunktionen for disse proteiner er regulerende, som det forekommer med enzymer.
Karakteristika for den tertiære struktur af kugleformede proteiner
Den tertiære struktur af kugleformede proteiner har nogle vigtige egenskaber:
- Globulære proteiner er kompakte takket være pakning ved at folde polypeptidkæden.
- De fjerne aminosyrerester i den primære struktur af polypeptidkæderne forbliver tæt på hinanden og er i stand til at interagere med hinanden på grund af foldningen.
- Større kugleformede proteiner (mere end 200 aminosyrer) kan have flere kompakte segmenter uafhængige af hinanden og med bestemte funktioner, og hvert af disse segmenter kaldes et domæne. Et domæne kan have mellem 50 og 350 aminosyrerester.
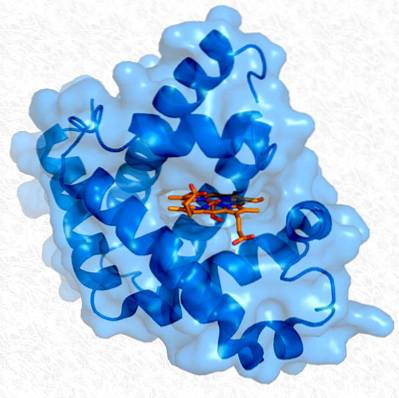
Tertiær struktur af myoglobin. Taget og redigeret fra: Thomas Splettstoesser. Modificeret af Alejandro Porto. [CC BY-SA 3.0 (https://creativecommons.org/licenses/by-sa/3.0)].
Generelle regler for foldning af kugleformede proteiner
Som allerede påpeget præsenterer proteiner særlige former for foldning, som også giver dem særlige egenskaber. Denne foldning er ikke tilfældig og favoriseres både af den primære og sekundære struktur og af nogle ikke-kovalente interaktioner, og der er også nogle fysiske begrænsninger for foldningen, for hvilke der er formuleret nogle regler:
- Alle kugleformede proteiner har definerede fordelingsmønstre med de hydrofobe R-grupper rettet mod det indre af molekylet og de hydrofile rester i det ydre lag. Dette kræver mindst to lag sekundær struktur. Β-α-β-sløjfen og α-α-toppunktet kan tilvejebringe disse to lag.
- Β-arkene er generelt arrangeret i en venstrehåndet rullet form..
- I en polypeptidkæde kan forskellige drejninger forekomme, der passerer fra en sekundær struktur til en anden, såsom β- eller y-drejninger, som kan vende kædens retning med fire aminosyrerester eller mindre..
- Globulære proteiner har α-helices, β-ark, vendinger og uregelmæssigt strukturerede segmenter.
Protein denaturering
Hvis et protein mister sin naturlige (naturlige) tredimensionelle struktur, mister det sin biologiske aktivitet og de fleste af sine specifikke egenskaber. Denne proces er kendt under navnet denaturering.
Denaturering kan forekomme, når naturlige miljøforhold ændrer sig, f.eks. Ved varierende temperatur eller pH. Processen er irreversibel i mange proteiner; andre kan dog spontant genvinde deres naturlige struktur, når normale miljøforhold genoprettes..
Referencer
- C.K. Mathews, K.E. van Holde & K.G. Ahern (2002). Biokemi. 3. udgave. Benjamin / Cummings Publishing Company, Inc.
- R. Murray, P. Mayes, D.C. Granner & V.W. Rodwell (1996). Harper's Biochemestry. Appleton & Lange.
- J.M. Berg, J.L. Tymoczko & L. Stryer (2002). Biokemi. 5. udgave. W. H. Freeman og Company.
- W.M. Becker, L.J. Kleinsmith & J. Hardin (2006) Cellens verden. 6. udgave. Pearson Education Inc..
- A. Lehninger (1978). Biokemi. Ediciones Omega, S.A.
- T. McKee & J.R. McKee (2003). Biokemi: Livets molekylære basis. 3. udgave. McGraw-HiII Companies, Inc..



Endnu ingen kommentarer