
Magnesiumfluoridstruktur, egenskaber, syntese, anvendelser
Det magnesiumfluorid det er et farveløst uorganisk salt, hvis kemiske formel er MgF2. Det findes i naturen som mineralet sellaite. Det har et meget højt smeltepunkt og er meget dårligt opløseligt i vand. Det er relativt inert, da f.eks. Dets reaktion med svovlsyre er langsom og ufuldstændig, og den modstår hydrolyse med flussyre (HF) op til 750 ° C..
Det er en forbindelse, der er lidt påvirket af højenergistråling. Derudover har det lavt brydningsindeks, høj korrosionsbestandighed, god termisk stabilitet, betydelig hårdhed og fremragende synlige, UV (ultraviolette) og IR (infrarøde) lystransmissionsegenskaber..
Disse egenskaber gør det til at have fremragende ydeevne inden for det optiske felt og gør det desuden til et nyttigt materiale som katalysatorunderstøtning, belægningselement, antireflekterende linser og vinduer til infrarød transmission, blandt andre applikationer..
Artikelindeks
- 1 Struktur
- 2 egenskaber
- 3 Syntese og forberedelse
- 4 anvendelser
- 4.1 Optik
- 4.2 Katalyse eller acceleration af reaktioner
- 4.3 Andre anvendelser
- 5 Referencer
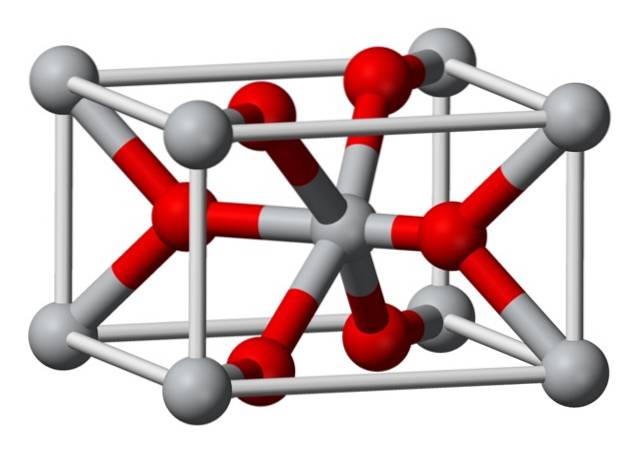
Struktur
Den krystallinske struktur af kemisk fremstillet magnesiumfluorid er af samme type som den af det naturlige mineral sellait. Krystalliserer i den dipyramidale klasse af det tetragonale system.
Magnesiumioner (Mg2 +) er placeret i et centreret tetragonal gitterrum, mens fluorioner (F-) findes i samme plan som og associeret med deres Mg2 + naboer, grupperet parvis med hinanden. Afstanden mellem Mg2 + og F-ioner er 2,07 Å (ångstrøm) (2,07 × 10-10m).
Dens krystalkoordination er 6: 3. Dette betyder, at hver Mg2 + -ion er omgivet af 6 F-ioner, og hver F-ion er igen omgivet af 3 Mg2 + 5-ioner..
Strukturen ligner meget den på mineralet rutil, som er den naturlige form for titandioxid (TiO2), som den har flere krystallografiske egenskaber til fælles med..
Under sin produktion udfældes magnesiumfluorid ikke som et amorft fast stof, fordi Mg2 + og F-ioner ikke har tendens til at danne polymere komplekser i opløsning..
Ejendomme
Interessant er magnesiumfluorid et dobbeltbrydende materiale. Dette er en optisk egenskab, der gør det muligt at opdele en indfaldende lysstråle i to separate stråler, der formerer sig ved forskellige hastigheder og bølgelængder..
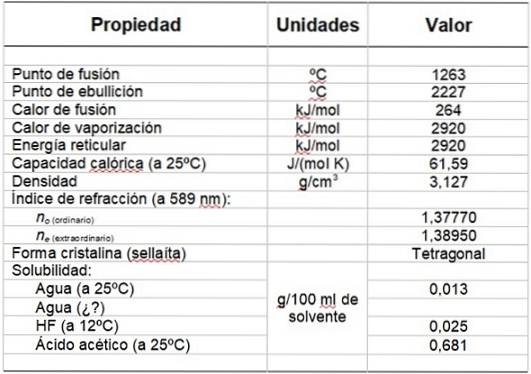
Tabel 1 viser nogle af dets egenskaber.
Tabel 1. Fysiske og kemiske egenskaber af magnesiumfluorid.
Syntese og forberedelse
Det kan fremstilles på forskellige måder, herunder følgende:
1-Gennem reaktionen mellem magnesiumoxid (MgO) eller magnesiumcarbonat (MgCO3) med flussyre (HF) 2:
MgO + 2 HF MgF2 + H2O
MgCO3 + 2 HF MgF2 + CO2 + H2O
2-ved reaktion mellem magnesiumcarbonat og ammoniumbifluorid (NH4HF2), begge i fast tilstand, ved en temperatur mellem 150 og 400 ° C2:
150-400ºC
MgCO3 + NH4HF2 MgF2 + NH3 + CO2 + H2O
3-opvarmning af en vandig opløsning af magnesiumcarbonat og ammoniumfluorid (NH4F) i nærvær af ammoniumhydroxid (NH4OH) ved 60 ° C 2:
60 ° C, NH4OH
MgCO3 + 3 NH4F NH4MgF3 + (NH4) 2CO3
Det resulterende bundfald af magnesiumammoniumfluorid (NH4MgF3) opvarmes derefter ved 620 ° C i 4 timer til opnåelse af magnesiumfluorid:
620 ° C
NH4MgF3 MgF2 + NH3 + HF
4-Som et biprodukt fra opnåelse af beryllium (Be) og uran (U). Fluoridet af det ønskede element opvarmes med metallisk magnesium i en digel belagt med MgF22:
BeF2 + Mg Be + MgF2
5-reagerende magnesiumchlorid (MgCl2) med ammoniumfluorid (NH4F) i vandig opløsning ved stuetemperatur 3:
25 ° C, H2O
MgCl2 + 2 NH4F MgF2 + 2NH4Cl
Da fremgangsmåderne til fremstilling af MgF2 er dyre, er der forsøg på at opnå det mere økonomisk, blandt hvilke metoden til produktion af det startende fra havvand skiller sig ud..
Dette er kendetegnet ved tilsætning af en tilstrækkelig mængde fluorioner (F-) til havvand, som har en rigelig koncentration af magnesiumioner (Mg2 +), hvilket favoriserer udfældningen af MgF2..
Optiske magnesiumfluoridkrystaller opnås ved varm presning af MgF2-pulver af høj kvalitet, opnået for eksempel ved NH4HF2-metoden.
Der er mange teknikker til fremstilling af magnesiumfluoridmaterialer, såsom enkeltkrystalvækst, sintring (komprimering til form eller formning) uden tryk, varmpressning og mikrobølgeovnsintring..
Ansøgninger
Optik
MgF2-krystaller er egnede til optiske applikationer, fordi de er gennemsigtige fra UV-regionen til det mellemste IR-område 2.10.
Som en inaktiv film bruges den til at ændre optiske og elektroniske materialers lystransmissionsegenskaber. En af hovedapplikationerne er inden for VUV-optik til teknologi til rumforskning.
På grund af dets dobbeltbrydningsegenskab er dette materiale nyttigt i polariseringsoptik, i vinduer og prismer i Excimer Laser (en type ultraviolet laser, der anvendes i øjenkirurgi)..
Det skal bemærkes, at magnesiumfluoridet, der anvendes til fremstilling af tynde film optiske materialer, skal være fri for urenheder eller forbindelser, der er en kilde til oxid, såsom vand (H2O), hydroxidioner (OH-), carbonationer (CO3 = sulfationer (SO4 =) og lignende 12.
Katalyse eller acceleration af reaktioner
MgF2 er med succes anvendt som en katalysatorunderstøttelse til reaktion af eliminering af klor og tilsætning af brint i CFC'er (klorfluorcarboner), kendte kølemidler og aerosoldrivmidler, og er ansvarlig for skaderne på atmosfærens ozonlag.
De resulterende forbindelser, HFC (hydrofluorcarboner) og HCFC (hydrochlorfluorcarboner) præsenterer ikke denne skadelige virkning for atmosfæren 5.
Det har også været nyttigt som en katalysatorbærer til hydrodesulfurization (fjernelse af svovl) af organiske forbindelser..
Andre anvendelser
Materialerne, der genereres ved sammenkalkning af grafit, fluor og MgF2, udviser høj elektrisk ledningsevne, hvorfor de er blevet foreslået til brug i katoder og som elektrisk ledende materialer..
Eutektikken dannet af NaF og MgF2 har energilagringsegenskaber i form af latent varme, hvorfor det er blevet overvejet til brug i solenergisystemer..
Inden for biokemi anvendes magnesiumfluorid sammen med andre metalfluorider til at hæmme phosphoryloverførselsreaktioner i enzymer.
For nylig er MgF2-nanopartikler blevet testet med succes som lægemiddelafgivelsesvektorer i syge celler til behandling af kræft..
Referencer
- Buckley, H.E. og Vernon, W.S. (1925) XCIV. Krystalstrukturen af magnesiumfluorid. Philosophical Magazine Series 6, 49: 293, 945-951.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology, bind 11, femte udgave, John Wiley & Sons. ISBN 0-471-52680-0 (v.11).
- Peng, Minhong; Cao, Weiping; og Song, Jinhong. (2015). Fremstilling af MgF2 gennemsigtig keramik ved varmpressende sintring. Journal of Wuhan University of Technology-Mater: Sci. Ed. Bind 30 nr. 4.
- Непоклонов, И.С. (2011). Magnesiumfluorid. Kilde: Eget arbejde.
- Wojciechowska, Maria; Zielinski, Michal; og Pietrowski, Mariusz. (2003). MgF2 som en ikke-konventionel katalysatorbærer. Journal of Fluorine Chemistry, 120 (2003) 1-11.
- Korth Kristalle GmbH. (2019). Magnesiumfluorid (MgF2). Hentet 12-07-2019 på: korth.de
- Sevonkaev, Igor og Matijevic, Egon. (2009). Dannelse af magnesiumfluoridpartikler med forskellige morfologier. Langmuir 2009, 25 (18), 10534-10539.
- Непоклонов, И.С. (2013). Magnesiumfluorid. Kilde: Eget arbejde.
- Tao Qin, Peng Zhang og Weiwei Qin. (2017). En ny metode til at syntetisere billige magnesiumfluoridkugler fra havvand. Ceramics International 43 (2017) 14481-14483.
- Ullmann's Encyclopedia of Industrial Chemistry (1996) Femte udgave. Bind A11. VCH Verlagsgesellschaft mbH. New York. ISBN 0-89573-161-4.
- NASA (2013). Ingeniører, der inspicerer Hubble-rumteleskopets primære spejl 8109563. Kilde: mix.msfc.nasa.gov



Endnu ingen kommentarer