
Kulstofegenskaber, struktur, opnåelse, anvendelser
Det kulstof Det er et ikke-metallisk kemisk element, hvis kemiske symbol er C. Det skylder kul, grøntsager eller mineraler, hvor dets atomer definerer forskellige strukturer. Mange forfattere betegner det som kongen af grundstofferne, da det danner en bred vifte af organiske og uorganiske forbindelser og også forekommer i et betydeligt antal allotropes..
Og hvis dette ikke er nok til at henvise til det som et specielt element, findes det i alle levende væsener; alle dets biomolekyler skylder deres eksistens til stabiliteten og styrken af CC-bindingerne og deres høje tendens til sammenkædning. Kulstof er livselementet, og med dets atomer er deres kroppe bygget.

De organiske forbindelser, som biomaterialer er bygget med, består praktisk talt af carbonskeletter og heteroatomer. Disse kan ses med det blotte øje i træets træ; og også når lynet rammer dem og rister dem. Det resterende inerte sorte faste stof har også kulstof; men det handler om trækul.
Der er således "døde" manifestationer af dette element: trækul, et produkt af forbrænding i iltfattige omgivelser; og mineralsk kul, et produkt af geologiske processer. Begge faste stoffer ligner hinanden, de er sorte, og de brænder for at generere varme og energi; dog med forskellige udbytter.
Fra dette tidspunkt er kulstof det 15. mest forekommende element i jordskorpen. Ikke underligt, når der produceres millioner af tons kul årligt. Disse mineraler adskiller sig i deres egenskaber afhængigt af graden af urenheder og placerer antracit som mineralsk kul af højeste kvalitet..
Jordskorpen er ikke kun rig på mineralsk kul, men også på carbonater, især kalksten og dolomitter. Og med hensyn til universet er det det fjerde mest rigelige element; Jeg mener, der er mere kulstof derude på andre planeter.
Artikelindeks
- 1 Historie af kulstof
- 1.1 Ser tilbage
- 1.2 Anerkendelse
- 2 egenskaber
- 2.1 Grafit vs diamant
- 3 Struktur og elektronisk konfiguration
- 3.1 Hybridiseringer
- 3.2 oxidationstal
- 3.3 Molekylære geometrier
- 3.4 Amorfe eller krystallinske faste stoffer
- 4 Opnåelse
- 5 anvendelser
- 6 Risici og forholdsregler
- 7 Referencer
Kulstofhistorie
Retrospekt
Kulstof kan være lige så gammelt som selve jordskorpen. Siden umindelige tider har gamle civilisationer stødt på dette element i dets mange naturlige præsentationer: sod, trækul, trækul, trækul, diamanter, grafit, kultjære, antracit osv..
Selv om de delte de mørke toner (med undtagelse af diamant), adskiller resten af disse faste stoffer sig bemærkelsesværdigt. Dengang var det umuligt at hævde, at de i det væsentlige bestod af kulstofatomer.
Det var således, at kul gennem historien blev klassificeret efter dets kvalitet, når det brændte og leverede varme. Og med de gasser, der blev dannet ved dens forbrænding, blev masser af vand opvarmet, hvilket igen producerede dampe, der flyttede turbiner, der genererede elektriske strømme..
Kulstof var uventet til stede i trækul produceret ved at brænde træer i lukkede eller hermetiske rum; i grafitten, hvormed blyanterne blev lavet; i diamanter brugt som ædelstene; var ansvarlig for stålets hårdhed.
Dens historie går hånd i hånd med træ, krudt, bybelysningsgasser, tog og skibe, øl, smøremidler og andre vigtige genstande til fremme af menneskeheden..
Anerkendelse
På hvilket tidspunkt var forskere i stand til at forbinde allotropes og mineraler af kulstof til det samme element? Kul blev betragtet som et mineral, og det blev ikke betragtet som et kemisk grundstof, der er værdigt til det periodiske system. Det første trin skulle have været at vise, at alle disse faste stoffer blev omdannet til den samme gas: kuldioxid, COto.
Antoine Lavoisier i 1772, ved hjælp af en træramme med store linser, fokuserede solens stråler på prøver af trækul og en diamant. Han opdagede, at ingen af dem dannede vanddampe, men COto. Han gjorde det samme med soden og fik de samme resultater..
Carl Wilhelm Scheele i 1779 fandt det kemiske forhold mellem trækul og grafit; begge faste stoffer var sammensat af de samme atomer.
Smithson Tennant og William Hyde Wollaston i 1797 bekræftede metodisk (gennem reaktioner), at diamant faktisk var sammensat af kulstof ved at producere COto i dens forbrænding.
Med disse resultater blev lys hurtigt kastet på grafit og diamant, faste stoffer dannet af kulstof og derfor af høj renhed; i modsætning til de urene faste stoffer af kul og andre kulstofholdige mineraler.
Ejendomme
De fysiske eller kemiske egenskaber, der findes i faste stoffer, mineraler eller kulstofholdige materialer, er underlagt mange variabler. Blandt dem er: sammensætningen eller graden af urenheder, hybridiseringerne af carbonatomer, mangfoldigheden af strukturer og porernes morfologi eller størrelse..
Når kulstofets egenskaber er beskrevet, er de fleste tekster eller bibliografiske kilder baseret på grafit og diamant..
Hvorfor? Fordi de er de mest kendte allotrope for dette element og repræsenterer faste stoffer eller materialer med høj renhed; de er praktisk taget lavet af intet andet end kulstofatomer (dog med forskellige strukturer, som det vil blive forklaret i det næste afsnit).
Egenskaberne ved trækul og mineralsk trækul adskiller sig i henholdsvis deres oprindelse eller sammensætning. For eksempel kryber brunkul (lavt kulstofindhold) som brændstof sammenlignet med antracit (højt kulstofindhold). Og hvad med de andre allotropes: nanorør, fullerener, grafener, graffiner osv..
Kemisk har de dog et punkt til fælles: de oxiderer med et overskud af ilt i COto:
C + ELLERto => COto
Nu er den hastighed eller temperatur, de har brug for for at oxidere, specifikke for hver af disse allotrope..
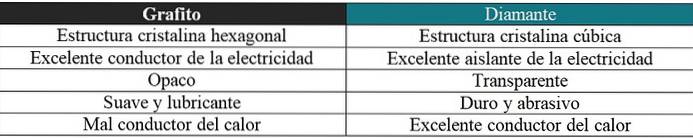
Grafit vs diamant
Her vil der også blive lavet en kort kommentar vedrørende de meget forskellige egenskaber for disse to allotrope:
Struktur og elektronisk konfiguration
Hybridiseringer
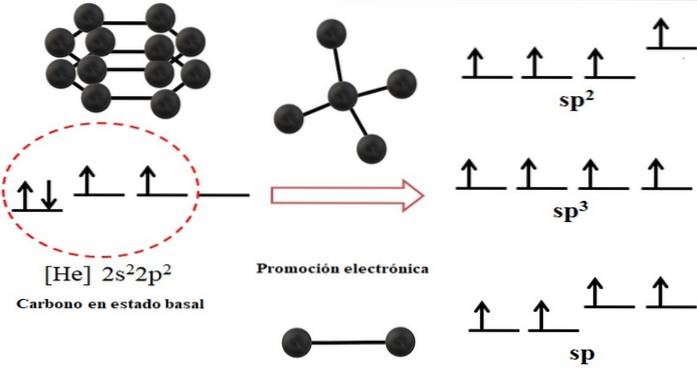
Elektronkonfigurationen for carbonatomet er 1sto2sto2 sto, også skrevet som [He] 2sto2 sto (øverste billede). Denne repræsentation svarer til dens grundtilstand: kulstofatomet isoleret og suspenderet i et sådant vakuum, at det ikke kan interagere med andre..
Det kan ses, at en af dens 2p orbitaler mangler elektroner, som accepterer en elektron fra den lavere energi 2s orbital gennem elektronisk promovering; og således erhverver atomet evnen til at danne op til fire kovalente bindinger gennem sine fire sp hybridorbitaler3.
Bemærk, at de fire sp orbitaler3 de er degenererede i energi (justeret på samme niveau). Orbitaler s rene er mere energiske, hvorfor de ligger over de andre hybridorbitaler (til højre for billedet).
Hvis der er tre hybridorbitaler, er det fordi en orbital er tilbage s uden hybridisering derfor er de tre sp orbitalerto. Og når der er to af disse hybridorbitaler, to orbitaler s er tilgængelige til dannelse af dobbelt- eller tredobbeltbindinger, idet de er carbon-hybridisering.
Sådanne elektroniske aspekter er afgørende for at forstå, hvorfor kulstof kan findes i uendelige allotroper..
Oxidationsnumre
Før du fortsætter med strukturerne, er det værd at nævne det i betragtning af valenselektronkonfigurationen 2sto2 sto, kulstof kan have følgende oxidationstal: +4, +2, 0, -2 og -4.
Hvorfor? Disse tal svarer til antagelsen om, at der findes en ionbinding, således at du danner ioner med de respektive ladninger; det vil sige C4+, Cto+, C0 (neutral), Cto- og C4-.
For at kulstof skal have et positivt oxidationsnummer, skal det miste elektroner; og for at gøre det skal det nødvendigvis være bundet til meget elektronegative atomer (som ilt).
I mellemtiden, for at kulstof skal have et negativt oxidationsnummer, skal det få elektroner ved at binde til metalliske atomer eller mindre elektronegativt end det (såsom brint).
Det første oxidationsnummer, +4, betyder, at kulstof har mistet alle valenselektroner; 2- og 2p-orbitalerne forbliver tomme. Hvis 2p-orbitalen mister sine to elektroner, vil kulstof have et oxidationsnummer på +2; hvis du får to elektroner, har du -2; og hvis du får yderligere to elektroner ved at udfylde din valensoktet, -4.
Eksempler
For eksempel til COto oxidationsantalet af kulstof er +4 (fordi ilt er mere elektronegativt); mens for CH4, er -4 (fordi brint er mindre elektronegativ).
For CH3OH, oxidationsantalet af kulstof er -2 (+1 for H og -2 for O); mens det for HCOOH er +2 (kontroller at summen giver 0).
Andre oxidationstilstande, såsom -3 og +3, er også sandsynlige, især når det kommer til organiske molekyler; for eksempel i methylgrupperne, -CH3.
Molekylære geometrier
Det øverste billede viste ikke kun hybridiseringen af orbitalerne til carbonatomet, men også de resulterende molekylære geometrier, når flere atomer (sorte kugler) var knyttet til et centralt. Dette centrale atom for at have et specifikt geometrisk miljø i rummet skal have den respektive kemiske hybridisering, der tillader det..
For eksempel for tetraeder har det centrale carbon sp-hybridisering3; fordi sådan er det mest stabile arrangement for de fire sp hybridorbitaler3. I tilfælde af sp carbonatomerto, de kan danne dobbeltbindinger og have et trigonalplanmiljø; og så definerer disse trekanter en perfekt sekskant. Og for en SP-hybridisering vedtager kulstofferne en lineær geometri.
Således er geometrier observeret i strukturer af alle allotroper simpelthen styret i tetraeder (sp3), sekskanter eller femkanter (spto) og linjer (sp).
Tetrahedra definerer en 3D-struktur, mens sekskanter, femkanter og linjer, 3D- eller 2D-strukturer; Sidstnævnte kommer til at være flyene eller pladerne, der ligner væggene i bikagerne:

Og hvis vi folder denne sekskantede væg (femkantet eller blandet), får vi et rør (nanorør) eller en kugle (fullerener) eller en anden figur. Interaktionerne mellem disse figurer giver anledning til forskellige morfologier.
Amorfe eller krystallinske faste stoffer
Bortset fra geometrier, hybridiseringer eller morfologier af de mulige strukturer af kulstof, kan dets faste stoffer klassificeres globalt i to typer: amorf eller krystallinsk. Og mellem disse to klassifikationer fordeles deres allotropes.
Amorft kulstof er simpelthen et, der præsenterer en vilkårlig blanding af tetraeder, sekskanter eller linjer, der ikke er i stand til at etablere et strukturelt mønster; sådan er det tilfældet med kul, trækul eller aktivt trækul, koks, sod osv..
Mens det krystallinske kulstof består af strukturelle mønstre dannet af en hvilken som helst af de foreslåede geometrier; for eksempel diamant (tredimensionelt netværk af tetraeder) og grafit (stablet sekskantede ark).
Opnåelse
Kulstof kan være rent som grafit eller diamant. Disse findes i deres respektive mineralogiske aflejringer, spredt over hele kloden og i forskellige lande. Derfor er nogle nationer mere eksportører af et af disse mineraler end andre. Kort sagt, "du skal grave jorden" for at få kulstof.
Det samme gælder mineralsk kul og dets typer. Men dette er ikke tilfældet med trækul, da en krop rig på kulstof først skal "omkomme", hverken under ild eller et elektrisk lyn; naturligvis i fravær af ilt, ellers frigøres COto.
En hel skov er en kulstofkilde som trækul; ikke kun for dets træer, men også for dens fauna.
Generelt skal prøver indeholdende kulstof gennemgå pyrolyse (brændende i fravær af ilt) for at frigøre nogle af urenhederne som gasser; og således forbliver et fast stof, der er rig på carbon (amorft eller krystallinsk), som en rest.
Ansøgninger
Igen, ligesom egenskaberne og strukturen, er anvendelserne eller applikationerne i overensstemmelse med de allotroper eller mineralogiske former for kulstof. Der er dog visse generaliteter, der kan nævnes ud over nogle kendte punkter. Sådanne er:
-Kulstof har længe været brugt som et mineralreduktionsmiddel til opnåelse af rene metaller; for eksempel jern, silicium og fosfor, blandt andre.
-Det er hjørnestenen i livet, og organisk kemi og biokemi er studiet af denne refleksion..
-Det har også været et fossilt brændstof, der gjorde det muligt for de første maskiner at dreje deres gear. På samme måde blev der opnået kulgas til det gamle belysningssystem. Kul var synonymt med lys, varme og energi.
-Blandet som tilsætningsstof med jern i forskellige proportioner tillod det opfindelsen og forbedring af stål.
-Dens sorte farve fandt sted i kunsten, især grafit og alle de skrifter, der blev lavet med dens streger..
Risici og forholdsregler
Kulstof og dets faste stoffer udgør ingen sundhedsrisiko. Hvem har nogensinde taget sig af en pose kul? De sælges i masser inden for gangene på nogle markeder, og så længe der ikke er ild i nærheden, vil deres sorte blokke ikke brænde..
Koks kan derimod udgøre en risiko, hvis svovlindholdet er højt. Når det brændes, frigiver det svovlegasser, der ud over at være giftige bidrager til sur regn. Og selvom COto i små mængder kan det ikke kvæle os, det har en enorm indvirkning på miljøet som drivhusgas.
Fra dette perspektiv er kulstof en "langsigtet" fare, da dens forbrænding ændrer klimaet på vores planet..
Og i en mere fysisk forstand transporteres de faste stoffer eller kulstofholdige materialer let, hvis de pulveriseres, med luftstrømme; og derfor indføres de direkte i lungerne, hvilket kan skade dem uopretteligt.
For resten er det meget almindeligt at indtage "trækul", når mad er kogt.
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Andrew. (2019). Kulstof, dets allotroper og strukturer. Gendannet fra: everyscience.com
- Advameg, Inc. (2019). Kul. Kemi forklaret. Gendannet fra: chemistryexplained.com
- Helmenstine, Anne Marie, Ph.D. (11. juli 2018). 10 kulstoffakta (atomnummer 6 eller C). Gendannet fra: thoughtco.com
- Tawnya Eash. (2019). Hvad er kulstof? - Fakta og historielektion for børn. Undersøgelse. Gendannet fra: study.com
- Föll. (s.f.). Historie af kulstof. Gendannet fra: tf.uni-kiel.de



Endnu ingen kommentarer