
Oxidative fosforyleringsfaser, funktioner og hæmmere
Det oxidativ fosforylering er en proces, hvor ATP-molekyler syntetiseres fra ADP og Pjeg (uorganisk fosfat). Denne mekanisme udføres af bakterier og eukaryote celler. I eukaryote celler finder fosforylering sted i den mitokondrie matrix af ikke-fotosyntetiske celler.
ATP-produktion drives af overførsel af elektroner fra coenzymerne NADH eller FADHto til Oto. Denne proces repræsenterer den højeste energiproduktion i cellen og stammer fra nedbrydningen af kulhydrater og fedtstoffer..
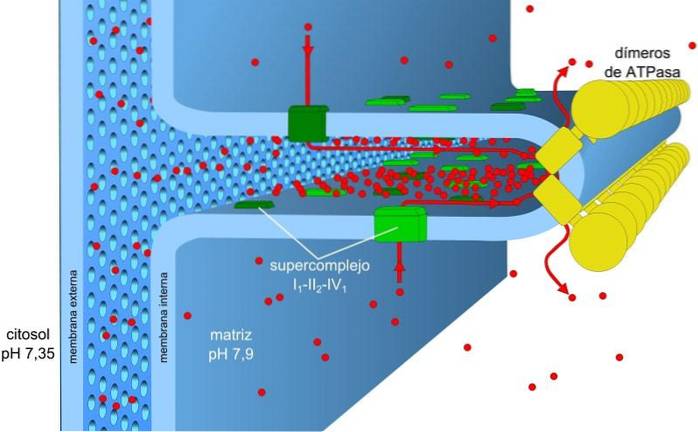
Den energi, der er lagret i ladnings- og pH-gradienter, også kendt som protonmotivkraften, gør det muligt for denne proces at finde sted. Protongradienten, der genereres, får den ydre del af membranen til at have en positiv ladning på grund af koncentrationen af protoner (H+) og den mitokondrie matrix er negativ.
Artikelindeks
- 1 Hvor forekommer oxidativ fosforylering?
- 1.1 Cellekraftværk
- 2 faser
- 2.1 Elektrontransportkæde
- 2.2 Succinat CoQ-reduktase
- 2.3 Kobling eller energitransduktion
- 2.4 Kemosmotisk kobling
- 2.5 ATP-syntese
- 3 produkter
- 4 funktioner
- 5 Kontrol af oxidativ fosforylering
- 5.1 Koordineret kontrol af ATP-produktion
- 5.2 Kontrol af acceptor
- 5.3 Afkoblingsmidler
- 5.4 Hæmmere
- 6 Referencer
Hvor forekommer oxidativ fosforylering?
Processerne med elektrontransport og oxidativ fosforylering er forbundet med en membran. I prokaryoter udføres disse mekanismer gennem plasmamembranen. I eukaryote celler associeres de med den mitokondriale membran.
Antallet af mitokondrier, der findes i celler, varierer afhængigt af celletypen. For eksempel mangler erytrocytter hos pattedyr disse organeller, mens andre celletyper, såsom muskelceller, kan have op til millioner af dem..
Den mitokondrie membran består af en simpel ydre membran, en noget mere kompleks indre membran, og imellem dem det intermembrane rum, hvor mange ATP-afhængige enzymer er placeret.
Den ydre membran indeholder et protein kaldet porin, der danner kanaler for den enkle diffusion af små molekyler. Denne membran er ansvarlig for at opretholde mitokondriernes struktur og form.
Den indre membran har en højere densitet og er rig på proteiner. Det er også uigennemtrængeligt for molekyler og ioner, så for at krydse det har de brug for intermembrane proteiner for at transportere dem..
Inde i matrixen strækker foldene af den indre membran sig ud og danner kamme, der gør det muligt at have et stort område i et lille volumen.
Cellekraftværk
Mitokondrionen betragtes som den centrale producent af cellulær energi. Den indeholder de enzymer, der er involveret i processerne i citronsyrecyklus, fedtsyreoxidation og redoxenzymer og proteiner til elektrontransport og ADP-phosphorylering.
Protonkoncentrationsgradienten (pH-gradient) og ladningsgradienten eller det elektriske potentiale i mitokondriernes indre membran er ansvarlige for protonens drivkraft. Den lave permeabilitet af den indre membran for ioner (bortset fra H.+) tillader mitokondrier at have en stabil spændingsgradient.
Elektronisk transport, protonpumpning og ATP-opnåelse sker samtidigt i mitokondrierne takket være protonmotivkraften. PH-gradienten opretholder sure betingelser i intermembranen og den mitokondrie matrix under alkaliske forhold.
For hver to elektroner, der overføres til Oto ca. 10 protoner pumpes gennem membranen og skaber en elektrokemisk gradient. Den energi, der frigøres ved denne proces, produceres gradvist ved passage af elektroner gennem transportkæden.
Niveauer
Energien frigivet under oxidationsreduktionsreaktionerne af NADH og FADHto er betydeligt høj (ca. 53 kcal / mol for hvert par elektroner), så den skal produceres gradvist med passage af elektroner gennem transportører for at kunne anvendes til fremstilling af ATP-molekyler.
Disse er organiseret i fire komplekser placeret på den indre mitokondrie membran. Koblingen af disse reaktioner til syntesen af ATP udføres i et femte kompleks.
Elektron transportkæde
NADH overfører et par elektroner, der kommer ind i kompleks I i elektrontransportkæden. Elektroner overføres til flavinmononukleotidet og derefter til ubiquinon (coenzym Q) gennem en jern-svovltransporter. Denne proces frigiver en stor mængde energi (16,6 kcal / mol).
Ubiquinon transporterer elektroner over membranen til kompleks III. I dette kompleks passerer elektronerne gennem cytokromer b og c1 takket være en jern-svovltransportør.
Elektroner passerer fra kompleks III til kompleks IV (cytochrom c oxidase), overføres en efter en i cytochrom c (perifert membranprotein). I kompleks IV passerer elektronerne gennem et par kobberioner (Cutilto+efterfulgt af cytochrom ctil, derefter til et andet par kobberioner (Cubto+) og fra dette til cytochrom a3.
Endelig overføres elektronerne til Oto som er den sidste acceptor og danner et vandmolekyle (HtoO) for hvert modtaget elektronpar. Passagen af elektroner fra kompleks IV til Oto Det genererer også en stor mængde fri energi (25,8 kcal / mol).
Succinat CoQ-reduktase
Kompleks II (succinat CoQ-reduktase) modtager et par elektroner fra citronsyrecyklussen ved oxidation af et succinatmolekyle til fumarat. Disse elektroner overføres til FAD og passerer derefter gennem en jern-svovlgruppe til ubiquinon. Fra dette coenzym passerer de til kompleks III og følger den tidligere beskrevne rute.
Den frigivne energi i elektronoverførselsreaktionen til FAD er ikke nok til at drive protonerne gennem membranen, så der genereres ingen protonmotivkraft i dette trin i kæden, og derfor giver FADH mindre H+ at NADH.
Kobling eller transduktion af energi
Den energi, der genereres i den tidligere beskrevne elektrontransportproces, skal kunne bruges til produktion af ATP, en reaktion katalyseret af enzymet ATP-syntase eller kompleks V. Bevarelsen af denne energi er kendt som energikobling, og mekanismen er blevet vanskeligt at karakterisere.
Flere hypoteser er blevet beskrevet for at beskrive denne energitransduktion. Den bedst accepterede er den kemiosmotiske koblingshypotese, beskrevet nedenfor..
Kemosmotisk kobling
Denne mekanisme foreslår, at den energi, der bruges til ATP-syntese, kommer fra en protongradient i cellemembraner. Denne proces griber ind i mitokondrier, kloroplaster og bakterier og er forbundet med transport af elektroner.
Komplekser I og IV i elektrontransport fungerer som protonpumper. Disse gennemgår konformationsændringer, der gør det muligt for dem at pumpe protoner ud i mellemrummet. I kompleks IV pumpes to protoner for hvert par elektroner ud af membranen, og der forbliver yderligere to i matrixen og danner HtoELLER.
Ubiquinon i kompleks III accepterer protoner fra kompleks I og II og frigiver dem til ydersiden af membranen. Komplekser I og III tillader hver passage af fire protoner for hvert par transporterede elektroner.
Den mitokondrie matrix har en lav koncentration af protoner og et negativt elektrisk potentiale, mens intermembranrummet præsenterer de omvendte forhold. Strømmen af protoner gennem denne membran repræsenterer den elektrokemiske gradient, der lagrer den nødvendige energi (± 5 kcal / mol pr. Proton) til syntesen af ATP..
ATP-syntese
Enzymet ATP-synthetase er det femte kompleks involveret i oxidativ phosphorylering. Det er ansvarligt for at udnytte energien fra den elektrokemiske gradient til dannelse af ATP.
Dette transmembrane protein består af to komponenter: F0 og F1. Komponent F0 tillader returnering af protoner til den mitokondrie matrix, der fungerer som en kanal og F1 katalyserer syntesen af ATP ved ADP og P.jeg, ved hjælp af energien fra nævnte retur.
ATP-synteseprocessen kræver en strukturændring i F1 og samling af komponenter F0 og F1. Proton translokation gennem F0 forårsager konformationsændringer i tre underenheder af F1, tillader det at fungere som en rotationsmotor, der styrer dannelsen af ATP.
Den underenhed, der er ansvarlig for bindingen af ADP med Pjeg den går fra en svag tilstand (L) til en aktiv tilstand (T). Når ATP dannes, går en anden underenhed i en åben tilstand (O), der tillader frigivelse af dette molekyle. Efter frigivelse af ATP går denne underenhed fra åben tilstand til inaktiv tilstand (L).
ADP- og P-molekylerjeg binde til en underenhed, der er gået fra en O-tilstand til en L-tilstand.
Produkter
Elektrontransportkæden og phosphorylering producerer ATP-molekyler. Oxidationen af NADH producerer ca. 52,12 kcal / mol (218 kJ / mol) fri energi.
Den samlede reaktion for oxidation af NADH er:
NADH + 1⁄2 Oto +H+ ↔ HtoO + NAD+
Overførsel af elektroner fra NADH og FADHto opstår gennem forskellige komplekser, der tillader, at den frie energiændring ΔG ° opdeles i mindre energi "pakker", som er koblet til ATP-syntese.
Oxidationen af et NADH-molekyle genererer syntesen af tre ATP-molekyler. Mens oxidationen af et FADH-molekyleto par til syntesen af to ATP'er.
Disse co-enzymer kommer fra glykolyse- og citronsyrecyklusprocesserne. For hvert molekyle glukose nedbrudt ender de med at producere 36 eller 38 molekyler ATP afhængigt af placeringen af cellerne. 36 ATP produceres i hjernen og skeletmuskulaturen, mens 38 ATP produceres i muskelvæv..
Funktioner
Alle organismer, encellede og flercellede, har brug for minimal energi i deres celler for at udføre processerne i dem og til gengæld opretholde vitale funktioner i hele organismen..
Metaboliske processer kræver energi for at finde sted. Det meste af den anvendelige energi opnås ved nedbrydning af kulhydrater og fedtstoffer. Denne energi stammer fra den oxidative fosforyleringsproces.
Kontrol af oxidativ fosforylering
ATP-udnyttelsesgraden i celler styrer dens syntese, og på grund af koblingen af oxidativ phosphorylering med elektrontransportkæden regulerer den igen generelt hastigheden af elektrontransport..
Oxidativ fosforylering har en streng kontrol, der sikrer, at ATP ikke genereres hurtigere, end det forbruges. Der er visse trin i elektrontransport og koblet fosforylering, der regulerer energiproduktionens hastighed..
Koordineret kontrol af ATP-produktion
De vigtigste veje til energiproduktion (cellulær ATP) er glykolyse, citronsyrecyklus og oxidativ fosforylering. Koordineret kontrol af disse tre processer regulerer ATP-syntese.
Kontrol af fosforylering ved hjælp af ATP's masseforhold afhænger af elektronernes nøjagtige bidrag i transportkæden. Dette afhænger igen af [NADH] / [NAD+], som holdes hævet ved glykolysevirkningen og citronsyrecyklussen.
Denne koordinerede kontrol udføres ved at regulere glykolysekontrolpunkterne (PFK hæmmet af citrat) og citronsyrecyklussen (Pyruvat dehydrogenase, citrat tapease, isocitrat dehydrogenase og α-ketoglutarat dehydrogenase)..
Kontrol af acceptor
Kompleks IV (cytochrom c oxidase) er et enzym reguleret af et af dets substrater, det vil sige, dets aktivitet styres af reduceret cytochrom c (cto+), som igen er i ligevægt med koncentrationsforholdet mellem [NADH] / [NAD+] og masseforholdet mellem [ATP] / [ADP] + [Pjeg].
Jo højere forholdet [NADH] / [NAD+] og sænk [ATP] / [ADP] + [Pjeg] jo højere er koncentrationen af cytochrom [cto+] og jo større er aktiviteten af kompleks IV. Dette fortolkes for eksempel, hvis vi sammenligner organismer med forskellige aktiviteter for hvile og høj aktivitet.
Hos et individ med høj fysisk aktivitet forbrug af ATP og dermed dets hydrolyse til ADP + Pjeg vil være meget høj og generere en forskel i massehandlingsforholdet, der forårsager en stigning i [cto+] og derfor en stigning i ATP-syntese. Hos en person i hvile opstår den omvendte situation.
I sidste ende øges hastigheden af oxidativ fosforylering med koncentrationen af ADP i mitokondrier. Denne koncentration afhænger af ADP-ATP-translokatorerne, der er ansvarlige for transporten af adeninnukleotider og Pjeg fra cytosol til mitokondrie matrix.
Afkoblingsmidler
Oxidativ fosforylering er påvirket af visse kemiske agenser, som tillader elektrontransport at fortsætte uden ADP-fosforylering, der frakobler energiproduktion og konservering.
Disse stoffer stimulerer mitokondriernes iltforbrugshastighed i fravær af ADP, hvilket også forårsager en stigning i ATP-hydrolyse. De handler ved at eliminere en mellemmand eller bryde en energitilstand i elektrontransportkæden.
2,4-dinitrophenol, en svag syre, der passerer gennem mitokondriale membraner, er ansvarlig for at sprede protongradienten, da de binder til dem på den sure side og frigiver dem på basissiden.
Denne forbindelse blev anvendt som en "diætpiller", da det viste sig at producere en stigning i respirationen, derfor en stigning i stofskiftehastighed og tilhørende vægttab. Imidlertid blev det vist, at dets negative virkning endda kunne medføre død.
Spredningen af protongradienten producerer varme. Celler i brunt fedtvæv bruger hormonalt kontrolleret frakobling til at producere varme. Dvalende pattedyr og nyfødte, der mangler hår, består af dette væv, der fungerer som en slags termisk tæppe..
Hæmmere
Forbindelser eller inhiberende midler forhindrer begge indtagelse af Oto (elektrontransport) såsom tilhørende oxidativ fosforylering. Disse agenter forhindrer dannelsen af ATP ved at bruge den energi, der produceres i elektronisk transport. Derfor stopper transportkæden, da energiforbruget ikke er tilgængeligt..
Det antibiotiske oligomycin fungerer som en phosphoryleringshæmmer i mange bakterier og forhindrer stimulering af ADP til ATP-syntese.
Der er også ionoformidler, der danner fedtopløselige komplekser med kationer, såsom K+ og Na+, og de passerer gennem mitokondrie membranen med disse kationer. Mitokondrierne bruger derefter energien produceret i elektrontransport til at pumpe kationer i stedet for at syntetisere ATP..
Referencer
- Alberts, B., Bray, D., Hopkin, K., Johnson, A., Lewis, J., Raff, M., Roberts, K. & Walter, P. (2004). Væsentlig cellebiologi. New York: Garland Science.
- Cooper, G. M., Hausman, R. E. & Wright, N. (2010). Cellen. (s. 397-402). Marban.
- Devlin, T. M. (1992). Lærebog i biokemi: med kliniske sammenhænge. John Wiley & Sons, Inc..
- Garrett, R. H., & Grisham, C. M. (2008). Biokemi. Thomson Brooks / Cole.
- Lodish, H., Darnell, J. E., Berk, A., Kaiser, C. A., Krieger, M., Scott, M. P., & Matsudaira, P. (2008). Molekylær cellebiologi. Macmillan.
- Nelson, D. L. og Cox, M. M. (2006). Lehninger Principper for biokemi 4. udgave. Ed Omega. Barcelona.
- Voet, D. og Voet, J. G. (2006). Biokemi. Panamerican Medical Ed..



Endnu ingen kommentarer