
Strukturformel (med eksempler)
Det strukturformel det er en grafisk gengivelse af bindingerne i et molekyle, der kaster lys over dets struktur, når den først er bestemt ved spektroskopiske metoder. Det er den mest specifikke måde, når der henvises til en bestemt forbindelse, og ikke til flere isomerer svarende til den samme molekylformel.
For eksempel butan, C4H10, har to isomerer: n-butan (lineær) og 2-methyl-propan (forgrenet). Molekylformlen skelner ikke mellem nogen af de to; mens vi griber til strukturformler, vil det præcist ses, at den ene er lineær og den anden forgrenet.
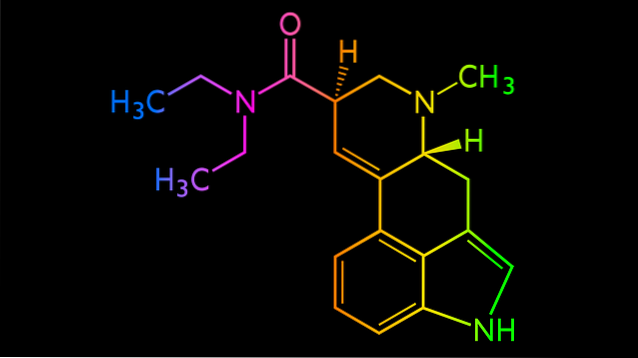
Brug af strukturformler gør det lettere at forstå de ændringer, som et molekyle gennemgår under en kemisk reaktion; hvilke af dens links, der er brudt, hvordan dens struktur ændres i processen og i slutningen af den. At lære at læse disse formler er det samme som overfladisk at forudsige molekylers egenskaber.
Strukturelle formler er 2D-repræsentationer, skønt de kan indikere nogle tredimensionelle og geometriske aspekter. Jo mere strukturen af en forbindelse undersøges, jo mere raffineret og trofast bliver dens strukturformel. Ellers udelader det væsentlige aspekter for at forstå molekylets natur.
Artikelindeks
- 1 Eksempler på strukturformel
- 1.1 Glukose
- 1.2 Metan
- 1.3 Methanol
- 1.4 Ethanol
- 1.5 Fruktose
- 1.6 Vand
- 1.7 Aspirin
- 1.8 Benzen
- 2 Referencer
Eksempler på strukturformel
Hver forbindelse har sin respektive strukturformel, som kan variere afhængigt af den anvendte projektions- eller perspektivtype. For eksempel er kondenserede og skeletformler, Lewis-strukturer og stereokemiske fremskrivninger alle strukturformler, dedikeret til at tegne så meget information som muligt om molekylær struktur..
Der er så mange, at kun et par enkle eksempler vil blive behandlet..
Glukose

Fire repræsentationer af glucosemolekylet er vist i det øverste billede. Hver er en gyldig strukturformel; men 2 (Haworth-projektion) og 3 (stolprojektion) er normalt de mest anvendte i akademiske tekster og i publikationer.
4 har den fordel, at den direkte angiver, hvilke OH-grupper der er over (tykke kiler) eller under (prikkede kiler) den sekskantede ring; det vil sige, det letter forståelsen af dets stereokemi. I modsætning hertil viser 1 (Tollens-Fisher-projektion) den lineære karakter af glukose, før den konverteres til dens cykliske form.
Metan
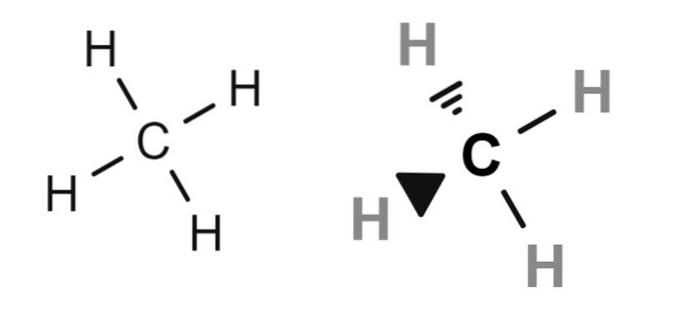
Ovenfor er der to strukturformler af metan, hvis kondenserede molekylformel er CH4. For dem, der mangler viden om kemi, kunne de fortolke formlen CH4 som om det var et molekyle med et hydrogenatom i midten.
Men i virkeligheden (og nødvendigvis) gør strukturformlerne det klart, at kulstof er det centrale atom. Derfor har vi fire CH-obligationer. Bemærk også, at formlen til venstre skaber det falske indtryk, at molekylet er fladt, når det i virkeligheden er tetraedrisk (formel til højre).
Derfor er bindingerne i strukturformlen til højre repræsenteret af kiler, der angiver de relative rumlige positioner for hvert hydrogenatom (tetraederens hjørner).
Methanol

Den strukturelle formel for methanol er praktisk talt den samme som for methan med den forskel, at den har et H substitueret med en OH. Dens kondenserede eller kemiske formel er CH3OH og det molekylære CH4O. Det bemærkes, at det også består af en tetraeder.
Ethanol
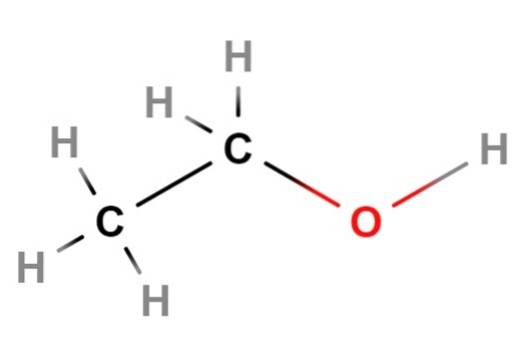
Nu går vi videre til ethanol, den næste alkohol på listen. Dens kemiske eller kondenserede formel er CH3CHtoOH, som i sig selv allerede viser sin lineære struktur. For at være sikker demonstrerer strukturformlen i billedet ovenfor effektivt, at ethanol er en lineær kæde eller et skelet..
Hvis du ser nøje, er omgivelserne for hvert carbonatom tetraedriske.
Fruktose

Ovenfor har vi strukturformlen fruktose, mere præcist Haworth-fremspringet på dens furanusring (femleddet). Bemærk, hvor meget strukturformlen afslører i modsætning til den molekylære, C6H12ELLER6, som falder sammen med glukose, begge er imidlertid forskellige sukkerarter.
Vand

Den kemiske formel for vand er HtoEller svarende også til de kondenserede og molekylære formler. Som med metan kan de, der ikke kender vandmolekylet (og ikke har nogen forestilling om kemiske bindinger), tro på, at dets struktur er O-H-H; men strukturformlen i billedet ovenfor tydeliggør den sande struktur.
Selvom det ikke forstås, trækker parene af frie elektroner af oxygen og hydrogenatomer en tetraeder omkring oxygenet; dette er vandets elektroniske geometri: tetraeder. I mellemtiden etablerer de to hydrogenatomer et plan svarende til en boomerang; dette er den molekylære geometri af vand: vinkel.
Selvom vandets strukturformel er langt den enkleste af de diskuterede eksempler, skjuler det flere hemmeligheder og anomalier, end det alene formår at repræsentere..
Aspirin
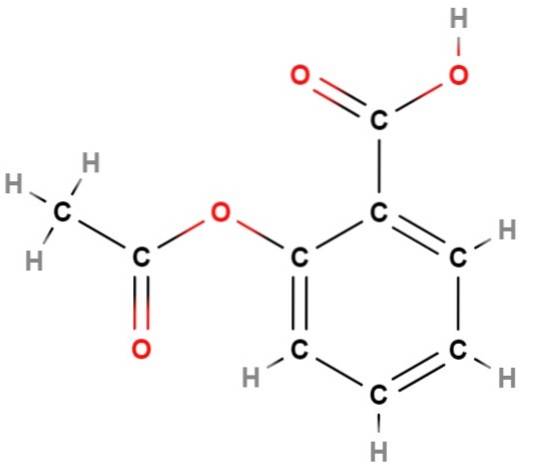
Vi har en af de første "fiaskoer" af strukturformler: deres manglende evne til at repræsentere den aromatiske karakter af en struktur; som i dette tilfælde svarer til aromatiseringen af benzen (hexagonal) ring af aspirin (ovenfor).
Hvis du ser på denne formel nøje, vil du konkludere, at det er et i det væsentlige fladt molekyle; det vil sige at næsten alle dets atomer "hviler" i det samme plan med undtagelse af methylgruppen, CH3, til venstre, hvor det tetraedriske miljø af kulstof igen visualiseres.
Igen giver strukturformlen meget mere information end dens almindelige molekylære formel, C9H8ELLER4; hvilket svarer til adskillige strukturelle isomerer, helt forskellige fra aspirin.
Benzen
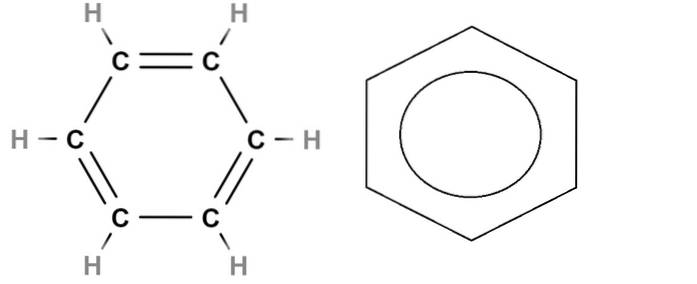
For at afslutte har vi over strukturformlen benzen. Dens molekylformel er C6H6, hvilket indikerer, at den indeholder seks carbonatomer og seks hydrogenatomer. Men det siger intet om den sande struktur af benzen.
C = C dobbeltbindinger er ikke statiske, da et par elektroner, specifikt den, der er placeret i orbitalerne s af kulstof, delokaliseres det inden i ringen. Derfor har benzen flere resonansstrukturer, hver med sin egen strukturformel..
Denne delokalisering er en del af den aromatiske karakter af benzen, ikke trofast repræsenteret i strukturformlen til venstre. Det tætteste er at erstatte dobbeltbindingerne med en cirkel (kaldet en doughnut af nogle) for at indikere aromatiseringen af ringen (til højre for billedet).
Og hvad med skeletformlen? Dette ligner meget det strukturelle, kun forskelligt ved, at det ikke repræsenterer hydrogenatomer; og derfor er det mere forenklet og mere behageligt at tegne. Benzenringen til højre ville være dens skeletformel.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2020). Strukturel formel. Gendannet fra: en.wikipedia.org
- Nissa Garcia. (2020). Strukturel formel: definition og eksempler. Undersøgelse. Gendannet fra: study.com
- Clark Jim. (2012). Tegning af organiske molekyler. Gendannet fra: chemguide.co.uk
- William Reusch. (5. maj 2013). Formen af molekyler. Gendannet fra: 2.chemistry.msu.edu



Endnu ingen kommentarer