
Minimumsformel hvordan man får minimumsformlen, eksempler og øvelser
Det minimal eller empirisk formel Det er et udtryk for den andel, hvor atomerne i de forskellige grundstoffer, der udgør en kemisk forbindelse, er til stede. Minimumsformlen er således den enkleste repræsentation af en kemisk forbindelse. Det er derfor, det er 'minimalt'.
Minimumsformlen udtrykker ikke antallet af atomer for de forskellige grundstoffer, der udgør en kemisk forbindelse; men den andel, hvori disse atomer kombineres for at danne den kemiske forbindelse.
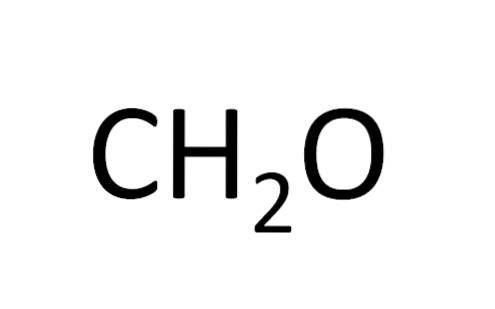
Minimumsformlen kaldes også den empiriske formel, da den opnås ved eksperimentering; det vil sige, det er relateret til erfaring. Eksperimentel observation tilladt at konkludere, at to hydrogenatomer kombineres med et hydrogenatom for at danne vand (HtoELLER).
I mange tilfælde matcher minimumsformlen molekylformlen. I molekylæret vises det reelle antal af de forskellige grundstoffer, der udgør en kemisk forbindelse; sådan er det f.eks. tilfældet med svovlsyre (HtoSW4).
Men i andre tilfælde er der ingen sammenfald mellem minimumsformlen og molekylformlen; Sådan er tilfældet med benzen: minimumsformlen er CH, mens dens molekylformel er C6H6.
Artikelindeks
- 1 Sådan får du minimumsformlen?
- 1.1 Første trin
- 1.2 Andet trin
- 1.3 Tredje trin
- 1.4 Fjerde trin
- 2 Eksempler på minimumsformel
- 2.1 Vand og kuldioxid
- 2.2 Basiske og sure oxider
- 2.3 Eddikesyre
- 2.4 Smørsyre
- 2.5 Ethylenglycol
- 2.6 Benzen
- 2.7 Glukose
- 3 Løst øvelser
- 3.1 - Øvelse 1
- 3.2 - Øvelse 2
- 4 Referencer
Sådan får du minimumsformlen?
Første skridt
Find gramene af hvert element, der er til stede i forbindelsen. Da de normalt udtrykkes som en procentdel af massen af forbindelsen, skal der foretages en simpel beregning for transformation af masseprocentdelene i massen af elementerne.
Andet trin
Det relative antal atomer for de forskellige grundstoffer, der udgør den kemiske forbindelse, opnås. For at gøre dette divideres massen af hvert element, udtrykt i gram, med dets atommasse.
Nogle forfattere foretrækker at kalde det relative antal atomer, da antallet af mol atomer af de grundstoffer, der er en del af den kemiske forbindelse.
Tredje trin
Opnåelse af den mindste andel, udtrykt i hele tal, af hvert af de atomer, der er til stede i den kemiske forbindelse.
For at finde disse værdier skal du dele det relative antal af hvert atom, der er til stede i forbindelsen, med den mindste relative numeriske værdi, som et atom har i den kemiske forbindelse..
I tilfælde af at værdien af minimumsandelen af et atom ikke er et heltal uden decimaler, skal alle værdierne for minimumsandelen ganges med et tal; på en sådan måde, at det tillader, at alle værdierne i minimumsproportionen er hele tal.
For eksempel, hvis værdien af den mindste andel af et atom af den kemiske forbindelse er 2,5, skal du gange alle sammen værdierne af den mindste andel af hvert af atomerne, der er til stede gange 2. Således vil alle værdierne for den mindste andel kun være hele tal.
Fjerde trin
Skriv minimumsformlen for forbindelsen. Værdierne for minimumsandelen for atomerne i de forskellige grundstoffer placeres som abonnementer på de kemiske symboler for grundstoffer for at skrive minimumsformlen.
Eksempler på minimumsformler
Vand og kuldioxid
De fleste kemiske forbindelser har formler, der er både minimale og molekylære formler. Formlen for vand (HtoO) er en minimal formel; men det er også en molekylær formel. Det samme gælder for formlen for kuldioxid (COto).
Basiske og sure oxider
Basiske og sure oxider er kemiske forbindelser, der har kemiske formler, med få undtagelser, der er både minimale og molekylære formler. Den samme situation opstår med hydroxider og syrer med undtagelse af nogle carboxylsyrer..
Eddikesyre
Carboxylsyrer, der har et lige antal carbonatomer i deres sammensætning, har hver for sig en minimumsformel og en molekylformel. Eddikesyre har for eksempel en molekylær formel (CtoH4ELLERto); men det har også en minimal formel (CHtoELLER).
Smørsyre
Smørsyre har også en molekylær formel (C4H8ELLERto) og en minimal formel (CtoH4ELLER).
Ethylenglycol
Andre organiske forbindelser har begge typer kemiske formler; sådan er tilfældet med ethylenglycol, som har en molekylær formel (CtoH6ELLERtoog en minimal formel (CH3ELLER).
Benzen
Benzen, en aromatisk forbindelse, har en molekylær formel (C6H6) og en minimal formel (CH).
Glukose
Glukose har en molekylær formel (C6H12ELLER6og en minimal formel (CHtoELLER).
Løst øvelser
- Øvelse 1
Ethylenglycol er en forbindelse, der anvendes som frostvæske, den har en molekylvægt på 62,1 g / mol og en masseprocentsammensætning som følger:
C: 38%,
H: 9,7%
Eller: 51,16%.
Første skridt
Udtryk masseprocenterne af elementerne i deres masser i gram. Til dette tages molekylvægten af ethylenglycol som reference. Hvis dette er 62,1 gram pr. Mol, består 38% af det af kulstof. Og så videre med de andre elementer:
Kulstofmasse = 62,1 g (38/100)
= 23,6 g
Masse af brint = 62,1 g (9,7 / 100)
= 6,024 g
Masse af ilt = 62,1 g (51,16 / 100)
= 31,77 g
Andet trin
Beregn det relative antal af hvert tilstedeværende atom (NRA) eller antallet af mol af hvert atom. For at gøre dette deles massen af hvert kemisk element med dets atommasse.
NRA (C) = 23,6 g / 12 g
= 1,97
Kan afrundes til 2.
NRA (H) = 6,024 g / 1 g
= 6,024
Kan afrundes til 6.
NRA (O) = 31,77 g / 16 g
= 1.985
Kan afrundes til 2.
Tredje trin
Beregn det minimale heltalsforhold for forbindelserne (PMNE). For at gøre dette skal du dividere hver af værdierne for de atomare relative tal (NRA) med den mindste værdi af dette. I dette tilfælde 2.
PMNE (C) = 2/2
= 1
PMNE (H) = 6/2
= 3
PMNE (O) = 2/2
= 1
Fjerde trin
Skriv minimumsformlen for ethylenglycol:
CH3ELLER
Som det kan ses, er værdierne opnået i trin 3 abonnementet på elementerne i forbindelsen.
- Øvelse 2
Eddikesyre har en molekylvægt på 60 g / mol og følgende sammensætning af masseprocent:
C: 40%
H: 6,67%
Eller: 53,33%
Få minimumsformlen for forbindelsen.
Første skridt
Transformér masseprocentdelene af elementerne til deres masser udtrykt i gram:
Kulstofmasse = 60 g (40/100)
= 24 g
Masse af brint = 60 g (6,67 / 100)
= 4 g
Masse af ilt = 60 g (53,33 / 100)
= 32 g
Andet trin
Beregn det relative antal atomer (NRA) af forbindelsen. For at gøre dette deles elementernes masser efter deres atommasser:
NRA (C) = 24 g / 12 g
= 2
NRA (H) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Tredje trin
Få det mindste hele talforhold mellem elementerne i forbindelsen (PMNE). For at gøre dette divideres NRA-værdierne for elementerne med den laveste NRA-værdi, som et element har:
PMNE (C) = 2/2
= 1
PMNE (H) = 4/2
= 2
PMNE (O) = 2/2
= 1
Fjerde trin
Skriv minimumsformlen for eddikesyre:
CHtoELLER
Subskriptionerne af forbindelsen er værdierne opnået fra PMNE.
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Helmenstine, Anne Marie, Ph.D. (27. august 2019). Empirisk formel: definition og eksempler. Gendannet fra: thoughtco.com
- Wikipedia. (2020). Empirisk formel. Gendannet fra: en.wikipedia.org
- Kemi LibreTexts. (3. juli 2019). Beregning af empiriske formler for forbindelser. Gendannet fra: chem.libretexts.org
- Nicola McDougal. (2020). Empirisk formel: definition, trin og eksempler. Undersøgelse. Gendannet fra: study.com



Endnu ingen kommentarer