
Natriumhydrid (NaH) egenskaber, reaktivitet, farer, anvendelser

Det natriumhydrid Det er en uorganisk forbindelse med formlen NaH. Det har en ionbinding mellem natrium og hydrid. Dens struktur er illustreret i figur 1. Den er repræsentativ for saltvandhydrider, hvilket betyder, at det er et hydrid svarende til salt, der består af Na + og H-ioner, i modsætning til mere molekylære hydrider såsom boran, methan, ammoniak og vand.
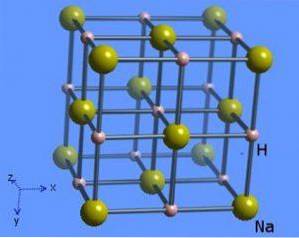
Krystalstrukturen har et koordinationsnummer 6, hvor hvert natriummolekyle er omgivet af 8 hydridioner, der præsenterer en oktaedrisk form og er illustreret i figur 2 (Mark Winter [University of Sheffield and WebElements Ltd, 1993-2016).
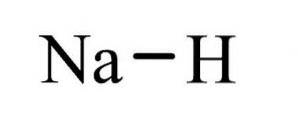
Forbindelsen fremstilles ved den direkte reaktion mellem natrium- og hydrogengas (Sodiumhydride Formula - Sodiumhydride Uses, Properties, Structure and Formula, 2005-2017) som følger:
H2 + 2Na → 2NaH
Natriumhydrid sælges kommercielt som en dispersionsform ved 60% vægt / vægt (vægt til vægtprocent) i mineralolie til sikker håndtering (SODIUM HYDRIDE, n.d.).
Artikelindeks
- 1 Fysiske og kemiske egenskaber af natriumhydrid
- 2 Reaktivitet og farer
- 3 anvendelser
- 4 Referencer
Fysiske og kemiske egenskaber af natriumhydrid
Natriumhydrid er et hvidt fast stof, når det er rent, selvom det generelt er gråt eller sølvfarvet. Dets udseende er vist i figur 3.

NaH har en molekylvægt på 23.99771 g / mol, en densitet på 1.396 g / ml og et smeltepunkt på 800 ° C (Royal Society of Chemistry, 2015). Det er uopløseligt i ammoniak, benzen, carbontetrachlorid og carbondisulfid (National Center for Biotechnology Information, n.d.).
Forbindelsen er ekstremt ustabil. Ren NaH kan let antænde i luft. Når det kommer i kontakt med vand i luften, frigiver det meget brandfarligt brint.
Når det er åbent for luft og fugt, hydrolyserer NaH også let ind i den stærke ætsende base af natriumhydroxid (NaOH) baseret på reaktionen:
NaH + H2O → NaOH + H2
I denne reaktion kan det ses, at natriumhydrid opfører sig som en base. Dette skyldes elektronegativiteten.
Natrium har signifikant lavere elektronegativitet (≈1.0) end brint (≈2.1), hvilket betyder, at brint trækker elektrondensiteten mod sig selv og bevæger sig væk fra natrium for at generere en natriumkation og et anionhydrid.
For at en forbindelse skal være en Brønsted-syre, skal den separere brintens elektrondensitet, det vil sige forbinde den til et elektronegativt atom, såsom ilt, fluor, nitrogen osv. Først da kan det formelt beskrives som H + og kan dissocieres som sådan.
Et hydrid er meget bedre beskrevet som H- og har et frit elektronpar. Som sådan er det en Brønsted-base, ikke en syre. Faktisk, hvis du udvider Brønsted-syre / base-definitionen som Lewis gjorde, vil du komme til den konklusion, at natrium (Na +) er den sure art her..
Brønsted-syre / base-reaktionsproduktet af base H- og syre H + bliver H2. Fordi surt hydrogen ekstraheres direkte fra vand, kan hydrogengas boble og fortrænger ligevægt, selvom reaktionen ikke begunstiges termodynamisk..
OH-ioner kan forblive, der kan skrives sammen med resten af Na + -kationen for at give natriumhydroxid (Hvorfor er fast natriumhydrid en base og ikke en syre, når den reageres med vand?, 2016).
Reaktivitet og farer
Forbindelsen er et kraftigt reduktionsmiddel. Angriber SiO2 i glas. Tændes ved kontakt med gasformigt F2, Cl2, Br2 og I2 (sidstnævnte ved temperaturer over 100 ° C), især i nærvær af fugt, til dannelse af HF, HCI, HBr og HI.
Reagerer med svovl for at give Na2S og H2S. Kan reagere eksplosivt med dimethylsulfoxid. Reagerer kraftigt med acetylen, selv ved -60 ° C. Det er spontant brandfarligt i fluor.
Indleder en polymerisationsreaktion i ethyl-2,2,3-trifluorpropionat, således at esteren nedbrydes voldsomt. Tilstedeværelsen i reaktionen af diethylsuccinat og ethyltrifluoracetat har forårsaget eksplosioner (SODIUM HYDRIDE, 2016).
Natriumhydrid betragtes som ætsende for huden eller øjnene på grund af potentialet for kaustiske biprodukter ved reaktioner med vand..
I tilfælde af kontakt med øjnene skal disse skylles med store mængder vand under øjenlågene i mindst 15 minutter og søg straks lægehjælp..
I tilfælde af hudkontakt børstes straks og skylles det berørte område med vand. Søg lægehjælp, hvis irritationen vedvarer..
Farlig ved indtagelse på grund af reaktion på vand. Fremkald ikke opkastning. Søg øjeblikkelig lægehjælp og overfør offeret til et medicinsk anlæg..
Natriumhydridoliedispersion er ikke pulver. Imidlertid kan det reagerende materiale udsende en fin kaustisk tåge. I tilfælde af indånding, skyl munden med vand og flyt personen ud i frisk luft. Søg lægehjælp (Rhom and Hass inc., 2007).
Ansøgninger
Den primære anvendelse af natriumhydrid er at udføre kondensations- og alkyleringsreaktioner, der udvikler sig ved dannelsen af en carbanion (katalyseret af basen).
Natriumhydrid i olie ligner natrium- og natriummetalalkoholater i dets evne til at fungere som et deprotoniserende middel i aceteddikesyreester, Claisen, Stobbe, Dieckmann-kondens og andre relaterede reaktioner. Det har markante fordele i forhold til andre kondensmidler ved, at:
- Det er en stærkere base, hvilket resulterer i en mere direkte deprotonering.
- Intet overskud er nødvendigt.
- Den producerede H2 giver et mål for omfanget af reaktionen.
- Bivirkninger såsom reduktioner elimineres.
Alkyleringer af aromatiske og heterocykliske aminer, såsom 2-aminopyridin og phenothiazin, opnås let i højt udbytte ved anvendelse af toluen-methylformamidblandinger. Dimethylformamidkoncentration er en variabel, der bruges til at kontrollere reaktionshastighed (HINCKLEY, 1957).
Anvendelsen af natriumhydrid er blevet foreslået til opbevaring af brint til anvendelse i brændselscellekøretøjer, idet hydridet er indesluttet i plastgranuler, der knuses i nærværelse af vand for at frigive brint..
Referencer
- HINCKLEY, M. D. (1957). Fremstilling, håndtering og anvendelse af natriumhydrid. Fremskridt inden for kemi, bind 19, 106-117.
- Mark Winter [University of Sheffield and WebElements Ltd, U. (1993-2016). Natrium: natriumhydrid. Hentet fra WebElements: webelements.com.
- National Center for Biotechnology Information. (s.f.). PubChem Compound Database; CID = 24758. Hentet fra PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom and Hass Inc. (2007, december). Natriumhydrid 60% spredning i olie. Hentet fra dow.com.
- Royal Society of Chemistry. (2015). Natriumhydrid. Hentet fra ChemSpider: chemspider.com.
- NATRIUMHYDRID. (2016). Hentet fra cameochemicals: cameochemicals.noaa.gov.
- Natriumhydridformel - Natriumhydrid Anvendelser, egenskaber, struktur og formel. (2005-2017). Hentet fra Softschools.com: softschools.com.
- NATRIUMHYDRID. (s.f.). Hentet fra chemicalland21: chemicalland21.com.
- Hvorfor er fast natriumhydrid en base og ikke en syre, når den reageres med vand? (2016, 20. april). Hentet fra stackexchange: chemistry.stackexchange.com.


Endnu ingen kommentarer