
Kviksølvhydroxidstruktur, egenskaber, anvendelser, risici

Det kviksølvhydroxid Det er en uorganisk forbindelse, hvor metalkviksølv (Hg) har et oxidationsnummer på 2+. Dens kemiske formel er Hg (OH)to. Imidlertid er denne art endnu ikke opnået i fast form under normale forhold..
Kviksølvhydroxid eller kviksølvhydroxid er et kortvarigt forbigående mellemprodukt i dannelsen af kviksølvoxid HgO i alkalisk opløsning. Fra undersøgelser udført i opløsninger af kviksølvoxid HgO er det blevet udledt, at Hg (OH)to det er en svag base. Andre arter, der ledsager den, er HgOH+ og Hgto+.

På trods af ikke at kunne udfældes i vandig opløsning, Hg (OH)to Det er opnået ved fotokemisk reaktion mellem kviksølv og brint og ilt ved meget lave temperaturer. Det er også opnået i form af et coprecipitat sammen med Fe (OH)3, hvor tilstedeværelsen af halogenidioner påvirker pH-værdien, ved hvilken der udfældes co.
Da det ikke let er opnået rent på laboratorieniveau, har det ikke været muligt at finde nogen anvendelse til denne forbindelse eller at bestemme risikoen for dens anvendelse. Det kan imidlertid udledes, at det udgør de samme risici som de andre kviksølvforbindelser.
Artikelindeks
- 1 Molekylets struktur
- 2 Elektronisk konfiguration
- 3 Nomenklatur
- 4 egenskaber
- 4.1 Molekylvægt
- 4.2 Kemiske egenskaber
- 5 Opnåelse
- 5.1 Rent kviksølvhydroxid
- 5.2 Co-udfældning med jern (III) hydroxid
- 6 anvendelser
- 7 Nylige undersøgelser
- 8 risici
- 9 Referencer
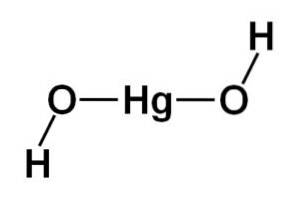
Molekylets struktur
Strukturen af kviksølv (II) hydroxid Hg (OH)to den er baseret på en lineær central del dannet af kviksølvatomet med de to iltatomer på siderne.
Hydrogenatomer er knyttet til denne centrale struktur, hver ved siden af hvert ilt, der roterer frit omkring hvert ilt. Det kunne repræsenteres på en enkel måde som følger:
Elektronisk konfiguration
Den elektroniske struktur af metallisk kviksølv Hg er som følger:
[Xe] 5d10 6sto
hvor [Xe] er elektronkonfigurationen af ædelgas-xenon.
Når man observerer denne elektroniske struktur, afledes det, at den mest stabile oxidationstilstand for kviksølv er den, hvor de 2 elektroner i lag 6 går tabt.s.
I kviksølvhydroxid Hg (OH)to, kviksølvatomet (Hg) er i dets 2+ oxidationstilstand. Derfor i Hg (OH)to kviksølv har følgende elektroniske konfiguration:
[Xe] 5d10
Nomenklatur
- Kviksølv (II) hydroxid
- Mercuric hydroxide
- Kviksølv dihydroxid
Ejendomme
Molekylær vægt
236,62 g / mol
Kemiske egenskaber
Ifølge de konsulterede oplysninger er det muligt, at Hg (OH)to være en forbigående forbindelse i dannelsen af HgO i et alkalisk vandigt medium.
Tilsætningen af hydroxylioner (OH-) til en vandig opløsning af kviksølvioner Hgto+ fører til udfældning af et gult kviksølv (II) oxid HgO, hvoraf Hg (OH)to er midlertidig eller midlertidig agent.

I vandig opløsning Hg (OH)to Det er et meget kortvarigt mellemprodukt, da det hurtigt frigiver et vandmolekyle og fast HgO bundfald.
Selv om det ikke har været muligt at udfælde kviksølvhydroxid Hg (OH)to, kviksølv (II) oxid HgO er noget opløseligt i vand og danner en opløsning af arter kaldet "hydroxider".
Disse arter i vand kaldet "hydroxider" er svage baser, og selvom de undertiden opfører sig som amfotere, generelt Hg (OH)to det er mere basisk end syre.
Når HgO opløses i HC14 undersøgelser indikerer tilstedeværelsen af kviksølvion Hgto+, en monohydroxymercuric ion HgOH+ og kviksølvhydroxid Hg (OH)to.
De ligevægte, der forekommer i sådanne vandige opløsninger, er som følger:
Hgto+ + HtoO ⇔ HgOH+ + H+
HgOH+ + HtoO ⇔ Hg (OH)to + H+
I alkaliske opløsninger af NaOH dannes arten Hg (OH)3-.
Opnåelse
Ren kviksølvhydroxid
Kviksølv (II) Hydroxid Hg (OH)to Det kan ikke opnås i vandig opløsning, fordi når man tilsætter alkali til en opløsning af kviksølvioner Hgto+, gul kviksølvoxid HgO udfældes.
Imidlertid lykkedes det nogle forskere at opnå kviksølvhydroxid Hg (OH) for første gang i 2005to ved hjælp af en kviksølvbuelampe, startende fra elementet kviksølv Hg, hydrogen Hto og ilt Oto.

Reaktionen er fotokemisk og blev udført i nærværelse af fast neon, argon eller deuterium ved meget lave temperaturer (ca. 5 K = 5 grader Kelvin). Bevis for dannelse af forbindelser blev opnået ved hjælp af IR (infrarød) lysabsorptionsspektre.
Hg (OH)to forberedt på denne måde er det meget stabilt under oplevelsesbetingelserne. Det estimeres, at den fotokemiske reaktion forløber gennem det mellemliggende O-Hg-O til det stabile molekyle H-O-Hg-O-H.
Coprecipitation med jern (III) hydroxid
Hvis kviksølv (II) sulfat HgSO opløses4 og jern (III) sulfat Feto(SW4)3 i sur vandig opløsning, og pH begynder at stige ved tilsætning af en opløsning af natriumhydroxid NaOH, efter stående tid dannes et fast stof, der udledes til at være et co-bundfald af Hg (OH)to og Fe (OH)3.
Det har vist sig, at dannelsen af Hg (OH)to er et kritisk trin i denne co-udfældning med Fe (OH)3.
Dannelsen af Hg (OH)to i bundfaldet Fe (OH)3-Hg (OH)to afhænger stærkt af tilstedeværelsen af ioner, såsom fluor, chlorid eller bromid, af deres specifikke koncentration og af opløsningens pH.
I nærvær af fluor (F-), ved pH større end 5, co-udfældning af Hg (OH)to med Fe (OH)3 det påvirkes ikke. Men ved en pH på 4 dannes dannelsen af komplekser mellem Hgto+ og F- interfererer med co-udfældning af Hg (OH)to.
I tilfælde af tilstedeværelse af chlorid (Cl-), co-udfældningen af Hg (OH)to forekommer ved en pH på 7 eller højere, dvs. fortrinsvis i et alkalisk medium.
Når bromid (Br-), co-udfældningen af Hg (OH)to forekommer ved endnu højere pH, dvs. pH over 8,5, eller mere alkalisk end med chlorid.
Ansøgninger
Fra gennemgangen af de tilgængelige informationskilder udledes det, at kviksølv (II) hydroxid Hg (OH)to, At være en forbindelse, der endnu ikke er fremstillet kommercielt, har den ingen kendte anvendelser.
Nylige undersøgelser
Ved hjælp af beregningssimuleringsteknikker i 2013 blev de strukturelle og energiske egenskaber relateret til hydrering af Hg (OH) undersøgt.to i gasform.
Metal-ligand-koordination og opløsningsenergier blev beregnet og sammenlignet ved at variere graden af hydrering af Hg (OH)to.
Blandt andet blev det fundet, at den teoretiske oxidationstilstand tilsyneladende er 1+ i stedet for den formodede 2+, der normalt tildeles Hg (OH)to.
Risici
Selvom Hg (OH)to som sådan er den ikke isoleret i tilstrækkelig mængde og derfor ikke blevet brugt kommercielt, dens specifikke risici er ikke blevet bestemt, men det kan udledes, at den udgør de samme risici som resten af kviksølvsalte.
Det kan være giftigt for nervesystemet, fordøjelsessystemet, huden, øjnene, åndedrætssystemet og nyrerne..
Indånding, indtagelse eller kontakt med huden af kviksølvforbindelser kan forårsage skader lige fra øjen- og hudirritation, søvnløshed, hovedpine, rysten, beskadigelse af tarmkanalen, hukommelsestab, til nyresvigt, blandt andre symptomer.
Kviksølv er blevet anerkendt internationalt som et forurenende stof. De fleste kviksølvforbindelser, der kommer i kontakt med miljøet, methyleres af bakterier, der er til stede i jord og sedimenter, og danner methylkviksølv.
Denne forbindelse bioakkumuleres i levende organismer, der går fra jorden til planter og derfra til dyr. I vandmiljøet er overførslen endnu hurtigere og går fra meget små til store arter på kort tid.
Methylkviksølv har en toksisk virkning for levende væsener og især for mennesker, der indtager det gennem fødekæden.
Når det indtages sammen med mad, er det især skadeligt for små børn og fostre hos gravide kvinder, da det er et neurotoksin, som kan forårsage skade på hjernen og nervesystemet i dannelse og vækst..
Referencer
- Cotton, F. Albert og Wilkinson, Geoffrey. (1980). Avanceret uorganisk kemi. Fjerde udgave. John Wiley & Sons.
- Wang, Xuefeng og Andrews, Lester (2005). Infrarødt spektrum af Hg (OH)to i Solid Neon og Argon. Uorganisk kemi, 2005, 44, 108-113. Gendannet fra pubs.acs.org.
- Amaro-Estrada, J.I., et al. (2013). Vandig opløsning af Hg (OH)to: Energetiske og dynamiske tæthedsfunktionelle teoristudier af Hg (OH)to-(HtoELLER)n (n = 1-24) Strukturer. J. Phys. Chem. A 2013, 117, 9069-9075. Gendannet fra pubs.acs.org.
- Inoue, Yoshikazu og Munemori, Makoto. (1979). Genudfældning af kviksølv (II) med jern (III) hydroxid. Miljøvidenskab og teknologi. Bind 13, nummer 4, april 1979. Gendannet fra pubs.acs.org.
- Chang, L.W., et al. (2010). Nervesystemet og adfærdstoksikologi. I omfattende toksikologi. Gendannet fra sciencedirect.com.
- Haney, Alan og Lipsey, Richard L. (1973). Akkumulering og virkninger af methylkviksølvhydroxid i en jordbaseret fødekæde under laboratorieforhold. Miljø. Forurener. (5) (1973) s. 305-316. Gendannet fra sciencedirect.com.



Endnu ingen kommentarer