
Bariumperoxid (BaO2) struktur, egenskaber og anvendelser

Det bariumperoxid er en ionisk og uorganisk forbindelse, hvis kemiske formel er BaOto. At være en ionisk forbindelse består den af Ba-ionerto+ migtoto-; sidstnævnte er det, der er kendt som peroxidanionen, og på grund af det BaOto får sit navn. Dette er tilfældet, BaOto er et uorganisk peroxid.
Opladningerne af dets ioner afslører, hvordan denne forbindelse dannes ud fra elementerne. Gruppe 2 bariummetal giver iltmolekylet to elektroner, Oto, hvis atomer ikke bruges til at reducere sig selv til oxidanioner, ORto-, men holdes sammen af et simpelt link, [O-O]to-.

Bariumperoxid er et granulært fast stof ved stuetemperatur, hvid i farve med lette gråtoner (øverste billede). Som næsten alle peroxider skal det håndteres og opbevares med forsigtighed, da det kan fremskynde oxidationen af visse stoffer.
Af alle peroxider dannet af metaller i gruppe 2 (Mr. Becambara), BaOto den er termodynamisk den mest stabile mod dens termiske nedbrydning. Ved opvarmning frigiver det ilt, og der produceres bariumoxid, BaO. BaO kan reagere med ilt i miljøet ved høje tryk for at danne BaO igento.
Artikelindeks
- 1 Struktur
- 1.1 Krystalgitterenergi
- 1.2 Hydrater
- 2 Forberedelse eller syntese
- 3 egenskaber
- 3.1 Fysisk udseende
- 3.2 Molekylær masse
- 3.3 Tæthed
- 3.4 Smeltepunkt
- 3.5 Kogepunkt
- 3.6 Opløselighed i vand
- 3.7 Termisk nedbrydning
- 4 Nomenklatur
- 5 anvendelser
- 5.1 Oxygenproducent
- 5.2 Producent af hydrogenperoxid
- 6 Referencer
Struktur
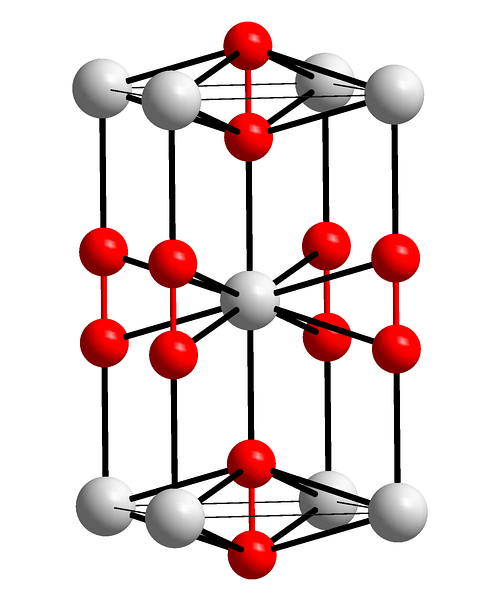
Det øverste billede viser den tetragonale enhedscelle af bariumperoxid. Inde i det kan man se kationerne Bato+ (hvide kugler) og anionerne Ototo- (røde kugler). Bemærk, at de røde kugler er forbundet med en enkelt binding, så de repræsenterer lineær geometri [O-O]to-.
Fra denne enhedscelle kan BaO-krystaller byggesto. Hvis observeret, anionen Ototo- det ses at være omgivet af seks Bato+, opnå en oktaeder, hvis hjørner er hvide.
På den anden side, endnu mere tydeligt, hver Bato+ er omgivet af ti Ototo- (hvid kugle i midten). Al krystal består af denne konstante korte og lange rækkefølge.
Krystalgitterenergi
Hvis de røde hvide kugler også observeres, bemærkes det, at de ikke adskiller sig for meget i deres størrelser eller ioniske radier. Dette er fordi kationento+ er meget omfangsrig, og dets interaktioner med anionen Ototo- stabilisere krystalens gitterenergi i bedre grad sammenlignet med hvordan fx kationer villeto+ og Mgto+.
Dette forklarer også, hvorfor BaO er den mest ustabile af de jordalkaliske oxider: Ba-ioner.to+ migto- adskiller sig betydeligt i størrelse og destabiliserer deres krystaller.
Da det er mere ustabilt, jo lavere er trenden med BaOto nedbrydes til dannelse af BaO; i modsætning til peroxider SrOto, CaOto og MgOto, hvis oxider er mere stabile.
Hydrater
BaOto kan findes i form af hydrater, hvoraf BaOto∙ 8HtoEller det er det mest stabile af alle; og faktisk er dette den, der markedsføres i stedet for det vandfrie bariumperoxid. For at opnå den vandfrie skal BaO tørres ved 350 ° Cto∙ 8HtoEller med det formål at fjerne vandet.
Dens krystalstruktur er også tetragonal, men med otte molekyler af HtoO interagerer med Ototo- gennem hydrogenbindinger og med Bato+ ved dipol-ion-interaktioner.
Andre hydrater, hvis strukturer der ikke er meget information i denne henseende, er: BaOto∙ 10HtoO, BaOto∙ 7HtoO og BaOto∙ HtoELLER.
Forberedelse eller syntese
Den direkte fremstilling af bariumperoxid består af oxidationen af dens oxid. Dette kan bruges fra mineralet barit eller fra bariumnitratsaltet Ba (NO3)to; begge opvarmes i en luft- eller iltberiget atmosfære.
En anden metode består i at reagere Ba (NO3)to med natriumperoxid:
Bad3)to + NatoELLERto + xHtoO => BaOto∙ xHtoO + 2NaNO3
Derefter hydrat BaOto∙ xHtoEller det udsættes for opvarmning, filtreres og færdiggøres ved tørring med vakuum.
Ejendomme
Fysisk fremtoning
Det er et hvidt fast stof, der kan blive gråligt, hvis det har urenheder (enten BaO, Ba (OH)to, eller andre kemiske arter). Hvis det opvarmes til en meget høj temperatur, afgiver det grønne flammer på grund af de elektroniske overgange af Ba-kationerne.to+.
Molekylær masse
169,33 g / mol.
Massefylde
5,68 g / ml.
Smeltepunkt
450 ° C.
Kogepunkt
800 ° C. Denne værdi er i overensstemmelse med hvad der kan forventes af en ionisk forbindelse; og endnu mere af den mest stabile jordalkalimetoxid. Imidlertid koger BaO ikke rigtigto, snarere frigives gasformigt ilt som et resultat af dets termiske nedbrydning.
Vandopløselighed
Uopløselig. Det kan dog langsomt gennemgå hydrolyse for at producere hydrogenperoxid, HtoELLERto; og desuden øges dets opløselighed i vandigt medium, hvis der tilsættes en fortyndet syre.
Termisk nedbrydning
Den følgende kemiske ligning viser den termiske nedbrydningsreaktion, som BaO gennemgårto:
2BaOto <=> 2BaO + Oto
Reaktionen er envejs, hvis temperaturen er over 800 ° C. Hvis trykket straks øges, og temperaturen falder, omdannes al BaO tilbage til BaOto.
Nomenklatur
En anden måde at navngive BaO påto det er bariumperoxid ifølge den traditionelle nomenklatur; da barium kun kan have valensen +2 i dets forbindelser.
Forkert bruges den systematiske nomenklatur til at henvise til den som bariumdioxid (binoxid), idet den betragtes som et oxid og ikke et peroxid.
Ansøgninger
Oxygenproducent
Ved hjælp af mineralbarit (BaO) opvarmes det med luftstrømme for at eliminere dets iltindhold ved en temperatur på omkring 700 ° C..
Hvis det resulterende peroxid opvarmes forsigtigt under vakuum, regenereres iltet hurtigere, og baritten kan genbruges på ubestemt tid for at opbevare og producere ilt..
Denne proces blev kommercielt udtænkt af L. D. Brin, nu forældet.
Hydrogenperoxidproducent
Bariumperoxid reagerer med svovlsyre for at producere hydrogenperoxid:
Bjælketo + HtoSW4 => HtoELLERto + Baso4
Det er derfor en kilde til HtoELLERto, manipuleret især med dets hydrat BaOto∙ 8HtoELLER.
I henhold til disse to nævnte anvendelser, BaOto tillader udvikling af Oto og HtoELLERto, både oxidationsmidler, i organisk syntese og i blegeprocesser i tekstil- og farveindustrien. Det er også et godt desinfektionsmiddel..
Desuden fra BaOto andre peroxider kan syntetiseres, såsom natrium, NatoELLERto, og andre bariumsalte.
Referencer
- S.C. Abrahams, J Kalnajs. (1954). Krystalstrukturen af bariumperoxid. Laboratorium for isolationsforskning, Massachusetts Institute of Technology, Cambridge, Massachusetts, USA.
- Wikipedia. (2018). Bariumperoxid. Gendannet fra: en.wikipedia.org
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Atomi. (2012). Bariumperoxid. Gendannet fra: barium.atomistry.com
- Khokhar et al. (2011). Undersøgelse af laboratorieforberedelse og udvikling af en proces til bariumperoxid. Gendannet fra: academia.edu
- PubChem. (2019). Bariumperoxid. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Fremstilling af bariumperoxid. Gendannet fra: prepchem.com



Endnu ingen kommentarer