
Natriumhydroxid (NaOH) struktur, egenskaber, anvendelser, syntese

Det natriumhydroxid Det er en uorganisk forbindelse, hvis kemiske formel er NaOH og består af en meget stærk metallisk base eller alkali. En 5% opløsning af det i vand har en pH-værdi tæt på 14.
Det er et meget hygroskopisk hvidt fast stof, der også kan absorbere kuldioxid fra luften til dannelse af natriumcarbonat. Det kommer kommercielt i plastflasker som piller, som ikke kan udsættes for længe for luften, og de skal heller ikke manipuleres med spatler.

Natriumhydroxid kan syntetiseres ved omsætning af calciumhydroxid med natriumcarbonat. For tiden er det imidlertid grundlæggende syntetiseret ved elektrolyse af saltopløsning og er et biprodukt fra produktionen af klorgas.
I betragtning af den høje basalitet af NaOH har den mange anvendelser og anvendelser, såsom produktion af papir, sæber, vaskemidler, farvestoffer osv. Det bruges også til husholdningsrengøring, vandbehandling, aluminiumsforarbejdning, medicinfremstilling osv. og frem for alt er det et sekundært mønster par excellence.
Natriumhydroxid er meget ætsende og kan forårsage irritation og forbrændinger i hud og øjne. Ved at indånde støvet kan det forårsage lungeødem. I mellemtiden kan indtagelse forårsage så alvorlig skade på fordøjelseskanalen, at det kan føre til døden..
Artikelindeks
- 1 Struktur
- 1.1 Vandfri
- 1.2 Hydrater
- 2 Fysiske og kemiske egenskaber
- 2.1 Navne
- 2.2 Molær masse
- 2.3 Udseende
- 2.4 Smeltepunkt
- 2.5 Kogepunkt
- 2.6 Opløselighed i vand
- 2.7 Grundlæggende (pKb)
- 2,8 pH
- 2.9 Brydningsindeks (nD)
- 2.10 Stabilitet
- 2.11 Nedbrydning
- 2.12 Selvantændelsespunkt
- 2.13 Viskositet
- 2.14 Fordampningsvarme
- 2.15 Overfladespænding
- 2.16 Reaktivitet
- 3 Syntese
- 3.1 Reaktion af natriumcarbonat og calciumhydroxid
- 3.2 Elektrolyse af natriumchlorid
- 4 anvendelser
- 4.1 Rengøringsprodukter
- 4.2 Farmaceutiske produkter og lægemidler
- 4.3 Energiprocesser
- 4.4 Vandbehandling
- 4.5 Papirfremstilling
- 4.6 Industriel produktion
- 5 risici
- 6 Referencer
Struktur
Vandfri

Det øverste billede viser de ioner, der udgør NaOH. Na-kationen+ er repræsenteret af den lilla kugle, mens hydroxylanionen (hydroxid eller hydroxyl) OH- ved den røde og hvide kugle. Begge Na-ioner+ og OH- interagere med hinanden gennem den elektrostatiske tiltrækning af deres modsatte ladninger.
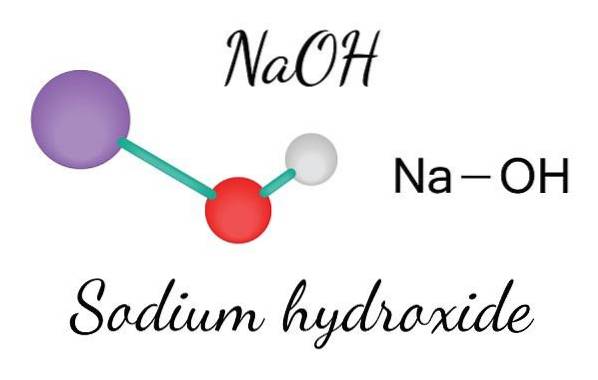
Sådanne interaktioner er ikke-retningsbestemte, så tiltrækningen af et ionpar Na+Åh- det kan påvirke andres i en bestemt afstand. Resultatet er, at Na-ionerne+ afvise hinanden på samme måde som OH-, indtil de definerer en krystal med minimal energi, hvor de etablerer en ordnet og periodisk struktur (krystallinsk).
Derfor vises de orthorhombiske krystaller af vandfri NaOH (uden vand):
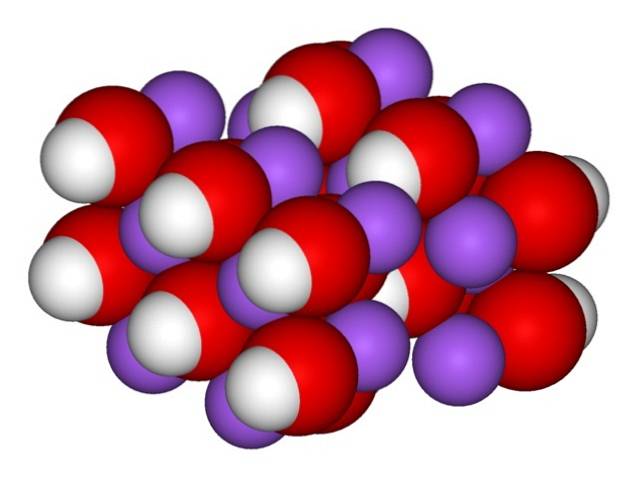
Ionerne forbliver tilstrækkeligt sammenhængende, så den vandfri NaOH-krystal smelter ved 323 ºC (så længe der ikke er nogen fugtighed i miljøet).
Hydrater
Både Na+ ligesom OH- De er ioner, som vandmolekyler let solverer (hydrat). Dette favoriserer dens hydrering over krystallernes retikulære energi, hvorfor NaOH frigiver en masse energi, når den kommer i kontakt med vand..
Vandfrie krystaller kan imidlertid være vært for uopløste vandmolekyler; dvs. natriumhydroxid kan danne adskillige hydrater, NaOH nHtoO. Vandmolekylet kan godt danne en hydrogenbinding med OH- (HOH-OH-) eller koordinere med Na+ (Na+-Åhto).
Afhængig af molforholdet mellem NaOH og H.toEller monohydrater (NaOHHtoO), dihydrater (NaOH 2HtoO), trihemidrater (NaOH 3,5HtoO), tetrahydrater (NaOH 4HtoO), heptahydrater (NaOH 7HtoO) og mere.
Hver af disse hydrater kan krystallisere fra en vandig opløsning af NaOH med forskellige masseprocentdele og ved forskellige temperaturer. Derfor udviser NaOH et kompliceret vandopløselighedsdiagram..
Generelt er krystallerne af hydrater mindre tætte og har lavere smeltepunkter. Dette skyldes, at vandmolekylerne "hindrer" interaktionen mellem Na+ og OH-, tilføje dipol-dipolkræfter ved ofring af ioniske attraktioner.
Fysiske og kemiske egenskaber
Navne
IUPAC foretrukket navn: natriumhydroxid. Andre navne: Kaustisk soda, Ascarite (mindre almindelig)
Molar masse
39,9971 g / mol
Udseende
Hvidt, serøst eller uigennemsigtigt fast stof eller krystaller.
Smeltepunkt
323 ºC
Kogepunkt
1.388 ºC
Vandopløselighed
1.000 g / L ved en temperatur på 25 ° C. Dette viser, hvor meget det kan opløses i vand..
Deres vandige opløsninger er viskøse med en viskositetsværdi omkring firs gange den for vand, og de frigiver først meget varme. Hvis du har kontakt med dem, gør de huden glat på grund af forsæbningen af fedtsyrerne i huden..
Grundlæggende (pKb)
- 0,56
pH
En 5% vægt / vægt opløsning i vand har en pH-værdi tæt på 14
Brydningsindeks (nD)
Ved en bølgelængde på 580,4 nm: 1.433 ved 320 ° C og 1.421 ved 420 ° C.
Stabilitet
Beholdere, der indeholder den, skal være lukket hermetisk for at forhindre dannelsen af natriumcarbonat. Dette skyldes dets høje hygroskopicitet, hvilket får det til at absorbere fugt fra omgivelserne og dets CO-indhold.to.
Nedbrydning
Når det opvarmes til nedbrydning, udsender det natriumoxidrøg.
Selvantændelsespunkt
Det er ikke brandfarligt
Viskositet
4,0 cPoise ved 350 ºC
Fordampningsvarme
175 kJ / mol ved 1.388 ºC
Overfladespænding
74,35 dynes / cm i en 2,72% w / w opløsning i vand ved 18 ºC.
Reaktivitet
Med syrer
Reagerer med organiske og uorganiske mineralsyrer, hvilket skaber vand og det tilsvarende salt. I tilfælde af svovlsyre er reaktionen eksoterm.
2 NaOH + HtoSW4 => NatoSW4 + 2 timertoELLER
Med syreoxider
Reagerer med svovldioxid, for eksempel, hvilket giver et sulfitsalt af og vand:
2 NaOH + SOto => NatoSW3 + HtoELLER
Med metaller
Dens vandige opløsninger reagerer med nogle metaller for at producere komplekse natriumsalte. For eksempel giver dens reaktion med zink et natriumzinkat:
Zn + 2 NaOH + 2 HtoO => Nato[Zn (OH)4] + Hto
Syntese
Natriumhydroxid syntetiseres hovedsageligt ved to metoder: brugen af natriumcarbonat, der oprindeligt blev brugt, og elektrolyse af natriumchlorid, der i øjeblikket er i større industriel anvendelse..
Reaktion af natriumcarbonat og calciumhydroxid
Natriumcarbonat reagerer med calciumhydroxid i en proces kendt som kaustisering:
Ca (OH)to + NatoCO3 => CaCO3 + NaOH
Calciumcarbonat udfældes, hvilket efterlader natriumhydroxid i supernatanten, som koncentreres ved inddampning.
Natriumcarbonat kommer tidligere fra Solvay-processen:
2 NaCl + CaCO3 => NatoCO3 + CaClto
Elektrolyse af natriumchlorid
Elektrolysen af natriumchlorid, der er til stede i saltlage, producerer hydrogengas, chloridgas og natriumhydroxid i vandig opløsning:
2 Nacl + 2 HtoO => Hto + Clto + 2 NaOH
Det elektrolytiske kammer består af et rum, hvor anoden (+) er lavet af titanmetal, og et sted, hvor saltvand er placeret. Dette rum er adskilt fra katodeafdelingen (-) med en porøs membran..
Følgende reaktion forekommer ved anoden:
2 Cl- => Clto + 2 e- (oxidation)
I mellemtiden forekommer denne reaktion ved katoden:
2 timertoO + 2 e- => Hto + Åh- (reduktion)
Natrium (Na+) diffunderer fra anodeafdelingen til katodeafdelingen gennem membranen, der adskiller dem og danner natriumhydroxid.
Ansøgninger
Rengøringsprodukter
Natriumhydroxid bruges til at fremstille sæber og rengøringsmidler, der bruges i hjemmet og i erhvervslivet. Kombinationen af natriumhydroxid og klor producerer klorblegemiddel, der bruges til vask af hvidt tøj.
Det eliminerer også ophobning af fedt i afløbene og producerer dets eliminering gennem dets omdannelse til sæber gennem forsæbningsprocessen. Dette muliggør fjernelse af blokering af rørene i husene og andre bygninger.
Farmaceutiske produkter og lægemidler
Natriumhydroxid bruges til at fremstille almindelige smertestillende midler, såsom aspirin. Også af lægemidler med antikoagulerende virkning, der blokerer dannelsen af blodpropper og lægemidler til at reducere hyperkolesterolæmi.
Energiprocesser
Natriumhydroxid bruges til fremstilling af brændselsceller, der fungerer som batterier til at producere elektricitet til en række anvendelser, herunder transport. Epoxyharpikser, der er fremstillet med intervention af natriumhydroxid, anvendes i vindmøller.
Vandbehandling
Natriumhydroxid bruges til at neutralisere surheden i vandet og bidrage til fjernelsen af tungmetaller fra det. Det bruges også til produktion af natriumhypochlorit, et vanddesinfektionsmiddel.
Natriumhydroxid omsættes med aluminiumsulfat til dannelse af aluminiumhydroxid: et flokkuleringsmiddel, der bruges i vandbehandlingsanlæg for at øge sedimenteringen af partikler og frembringe deres afklaring..
Papirfremstilling
Natriumhydroxid bruges sammen med natriumsulfid til behandling af træ for at opnå cellulose i næsten ren form, der danner basis for papir. Det bruges også til genbrug af papir, da det hjælper med at adskille blækket, så det kan bruges igen.
Industriel produktion
Natriumhydroxid anvendes til fremstilling af rayon, spandex, sprængstoffer, epoxyharpikser, glas og keramik. Det bruges i tekstilindustrien til fremstilling af farvestoffer og forarbejdning af bomuldsstoffer.
I sukkerrørrensningsanlæg anvendes natriumhydroxid ved lav temperatur til produktion af ethanol fra sukkerrør bagasse.
Risici
Natriumhydroxid er en stærkt ætsende forbindelse, så det kan forårsage forbrændinger, blærer og endda permanente ar ved hudkontakt.
I kontakt med øjnene kan det forårsage alvorlige forbrændinger, hævelse, smerte, sløret syn, og i alvorlige tilfælde kan det forårsage permanent blindhed..
Indtagelse af natriumhydroxid kan forårsage forbrændinger i læber, tunge, hals, spiserør og mave. Almindelige symptomer inkluderer kvalme, opkastning, mavekramper og diarré..
Selvom indånding af natriumhydroxid er sjælden og kun kan forekomme på grund af tilstedeværelsen af støv af forbindelsen i luften eller fra dannelsen af en tåge, der indeholder den, fremkalder det irritation i lungerne..
I tilfælde af kronisk eksponering kan dette forårsage lungeødem og svær åndenød, hvilket udgør en medicinsk nødsituation..
Referencer
- Shiver & Atkins. (2008). Uorganisk kemi. (Fjerde udgave). Mc Graw Hill.
- Wikipedia. (2019). Natriumhydroxid. Gendannet fra: en.wikipedia.org
- National Center for Biotechnology Information. (2019). Natriumhydroxid. PubChem-database. CID = 14798. Gendannet fra: pubchem.ncbi.nlm.nih.gov
- Amerikanske elementer. (2019). Natriumhydroxidopløsning. Gendannet fra: americanelements.com
- Kemiske sikkerhedsfakta. (2019). Natriumhydroxid. Gendannet fra: chemicalafetyfacts.org
- NJ Health. (2015). Natriumhydroxid. [PDF]. Gendannet fra: nj.gov
- Canadian Center for Occupational Health & Safety. (2019). OSH-svar Faktaark: natriumhydroxid. Gendannet fra: ccohs.ca
- Ausetute. (s.f.). Natriumhydroxid og klorproduktion ved elektrolyse. Gendannet fra: ausetute.com.au


Endnu ingen kommentarer