
Immunoglobulin D struktur, funktion og normale værdier

Det immunglobulin D (IgD), opdaget i 1965, er et overfladeimmunoglobulin, der findes (sammen med IgM) i membranen af B-lymfocytter (mIgD) inden deres aktivering.
Det har sin funktion som den første receptor for antigener. IgD er også frit i plasma takket være dets udskillelse (sIgD). Den har en molekylvægt på 185.000 Dalton og repræsenterer ca. 1% af immunglobulinerne i en organisme.
Artikelindeks
- 1 Hvad er immunglobuliner?
- 2 Struktur
- 3 Funktion og sygdomme
- 3.1 sIgD
- 3,2 mIgD
- 3,3 B-lymfocytter
- 3.4 Immun-inflammatorisk system
- 4 Normale værdier
- 4.1 Serumkoncentration
- 4.2 Blodværdier
- 5 Referencer
Hvad er immunglobuliner?
Immunglobuliner eller antistoffer er meget specifikke komplekse kugleformede glycoproteiner syntetiseret af B-lymfocytter, celler, der er ansvarlige for immunresponset i dyrenes krop..
Immunoglobuliner interagerer med molekyler, som kroppen identificerer som ikke-selv eller antigener. Ethvert stof, der er i stand til at aktivere immunresponset i kroppen kaldes et antigen..
Familien af Ig-antistofmolekyler inkluderer dem, der cirkulerer i blodplasma, og dem på overfladen af B-lymfocytter før deres aktivering..
Der er fem typer immunglobuliner: IgG, IgD, IgE, IgA og IgM (identificeret hos mennesker, mus, hunde, krybdyr, fisk, blandt andre), som adskiller sig strukturelt med hensyn til deres konstante regioner i den tunge kæde. Disse forskelle giver dem særlige funktionelle egenskaber.
Antistoffer fungerer som specifikke sensorer for antigener. Med disse danner de komplekser, der initierer en kaskade af reaktioner, der er typiske for immunsystemet. De generelle stadier i denne proces er: genkendelse, differentiering af specifikke lymfocytter og endelig effektorstadiet.
Struktur
Alle antistoffer er komplekse polypeptidmolekyler formet som et "Y". De består af fire polypeptidkæder, to af dem identiske lette (korte) kæder med hver 214 aminosyrer hver, og de andre to tunge (lange) kæder også identiske med hinanden, dobbelt så mange aminosyrer. En disulfidbinding forbinder en let kæde med en tung kæde.
Begge typer kæder har konstante regioner (karakteristisk for typen af antistof og den art, som organismen hører til), hvor aminosyresekvensen gentages fra et molekyle til et andet, og de har også variable regioner på ca. 100 aminosyrer i længde..
En disulfidbro (kovalent type binding) forbinder hver lette kæde til en tung kæde, og til gengæld kan en eller to af disse bindinger forbinde de to tunge kæder.
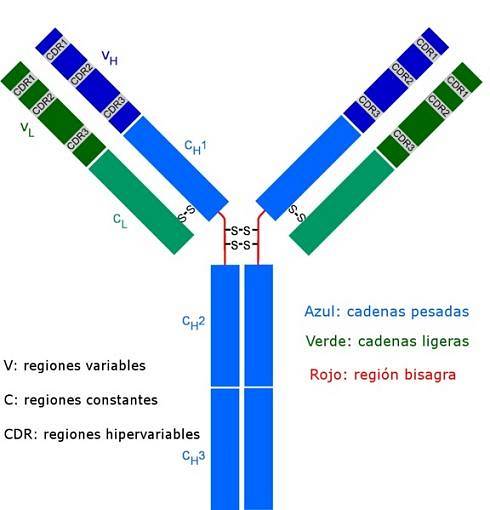
Disse steder er dem, der binder som en handske til en bestemt region af det specifikke antigen, epitop eller antigene determinant. Stabiliseringen af denne interaktion sker takket være adskillige ikke-kovalente bindinger.
Disse CDR-sekvenser er meget variable blandt antistoffer og genererer specificitet for forskellige typer antigener..
Med hensyn til immunoglobulin D's særlige egenskaber er det kendt, at det udviser en bred mangfoldighed blandt hvirveldyr. Generelt består det af to delta tunge kæder og to lette kæder. IgD er enten frit i serum eller bundet til B-lymfocytter gennem en Fc-receptor..
Funktion og sygdomme
Da IgD evolutionært er blevet bevaret fra bruskfisk (som befolket planeten for omkring 500 millioner år siden) til mennesker, menes det at tjene vitale immunfunktioner.
På trods af dette er det blevet mindst undersøgt af immunglobulinerne, for hvilke de specifikke funktioner af sIgD i serum endnu ikke er kendt nøjagtigt, mens flere funktioner er blevet foreslået for mIgD.
sIgD
En af årsagerne til den nylige interesse for undersøgelsen af sIgD har været konstateringen af høje niveauer af dette Ig hos nogle børn med periodisk feber. Til gengæld er en anden faktor af interesse, at det er nyttigt til overvågning af myelomer..
SIgD menes at spille en rolle i blodet, slimhindesekretionerne og på overfladen af medfødte immuneffektorceller, såsom basofiler.
De er meget reaktive mod patogener i åndedrætssystemet og deres udskillelsesprodukter. IgD er rapporteret at øge slimhindens immunitet takket være dens virkning på tilstedeværende bakterier og vira.
mIgD
Med hensyn til mIgD betragtes det som en membranantigenreceptor for B-lymfocytter, hvilket ville favorisere cellemodning. Det menes igen at være en ligand for IgD-receptorer i immunreguleringen af T-hjælperceller..
B-lymfocytter
IgD-producerende B-lymfocytter menes at repræsentere en bestemt cellelinie kaldet B-1-lymfocytter. Disse er selvreaktive lymfocytter, der har undgået den klonale sletning.
Autoantistofferne genereret af disse lymfocytter reagerer med deoxyribonukleinsyre eller DNA (enkelt og dobbeltstrenget) med cellereceptorer, cellemembranerne i røde blodlegemer og epitelvæv..
Sådan genererer de autoimmune sygdomme, såsom systemisk lupus erythematosus, myastheni gravis, autoimmun hæmolytisk anæmi og idiopatisk trombocytopeni purpura.
Immun-inflammatorisk system
Det er også kendt, at IgD'er er involveret i orkestrering af et system, der interfererer mellem immunsystemet og det inflammatoriske system: høje koncentrationer af IgD er relateret til autoinflammatoriske lidelser (hyperimmunoglobulæmi syndrom D, HIDS eller hyper-IgD).
For eksempel findes hos patienter med autoimmune tilstande, såsom reumatoid arthritis, forhøjede værdier af både sIgD og mIgD. Det menes derfor, at denne tilstand bidrager til sygdommens patogenese.
De mulige funktioner for dette antistof i mononukleære celler i perifert blod (PBMC) fra disse patienter undersøges i øjeblikket. Alt dette har ført til at overveje, at IgD kunne være et potentielt immunterapeutisk mål i behandlingen af reumatoid arthritis.
Normale værdier
SIgD hos normale individer varierer meget, hvilket har gjort det vanskeligt at etablere et nøjagtigt referenceinterval for deres normale koncentrationer. Nogle undersøgelser har vist, at denne variation især er påvirket af:
- Følsomheden af den anvendte påvisningsteknik - både ved radioimmunoanalyser (RIA), enzymimmunoanalyser (EIA) og den mest almindeligt anvendte i kliniske laboratorier, som er radioimmunodiffusion (RID)-.
- Fraværet af en enkelt bestemt universel metode til påvisning af IgD.
- Arvelige faktorer, race, alder, køn, graviditetsstatus, rygestatus, blandt andre
Nogle specialister mener endda, at rutineanalysen af IgD ikke er berettiget, fordi dens specifikke rolle langtfra er belyst, og omkostningerne ved analysen i det kliniske laboratorium er høje. Det ville kun være berettiget i tilfælde af patienter med monoklonalt serum IgD eller mistænkt for at have HIDS.
Serumkoncentration
På den anden side er det kendt, at sIgD generelt har en serumkoncentration, der er lavere end IgG, IgA og IgM, men højere end koncentrationen af IgE..
Desuden er plasmakoncentrationen mindre end 1% af det totale immunglobulin i serum, fordi den har en halveringstid på 2 til 3 dage. Nogle undersøgelser viser, at det repræsenterer 0,25% af det samlede serumimmunglobulin.
Blodværdier
Blandt de rapporterede værdier af sIgD i blod har det hos nyfødte været 0,08 mg / L (bestemt af RIA), hos spædbørn og voksne varierer det fra ikke-detekterbare værdier til 400 mg / L (afhængigt af alder og individer for hver individuel).
Hos normale voksne er de rapporteret som normale gennemsnit 25; 35; 40 og 50 mg / L. Generelt er den gennemsnitlige serumkoncentration for raske voksne rapporteret som 30 mg / L (bestemt ved RID)..
Som beskrevet i denne artikel er der imidlertid mange faktorer, der forhindrer oprettelse af en række standard normale værdier..
Referencer
- Chen, K. og Cerutti, A. (2011). Funktionen og reguleringen af immunglobulin D. Nuværende mening inden for immunologi, 23 (3), 345-52.
- Harfi, A. H. og Godwin, J.T. (1985). Normale serumniveauer af IgG, IgA, IgM, IgD og IgE i Saudi-Arabien. Annals of Saudi Medicine, bind 5, nr. 2.99-104. doi: 10.5144 / 0256-4947.1985.99
- Josephs, S.H. og Buckley, R.H. (1980). Serum IgD-koncentrationer hos normale spædbørn, børn og voksne og hos patienter med forhøjet IgE. The Journal of Pediatrics, bind 96, nr. 3, s. 417-420.
- Vladutiu, A.O. (2000). Immunoglobulin D: egenskaber, måling og klinisk relevans. Klinisk og diagnostisk laboratorieimmunologi, 7(2), 131-40.
- Voet, J.G. og Voet, W.P.D. (2005). Fundamentals of Biochemestry: Lyfe på molekylært niveau. Wiley. s. 1361.
- Wu, Y., Chen, W., Chen, H., Zhang, L., Chang, Y., Yan, S., Dai, X., Ma, Y., Huang, Q. og Wei, W. ( 2016). Det forhøjede udskilte immunglobulin D forstærkede aktiveringen af perifere mononukleære blodceller i reumatoid arthritis. PloS one, 11 (1). doi: 10.1371 / journal.pone.0147788



Endnu ingen kommentarer