
Hvad er det periodiske system til? 7 Vigtige anvendelser

Det periodiske system Det tjener til at vise forholdet mellem de forskellige elementer; Det kan også bruges til at forudsige egenskaberne for nye elementer, der endnu er opdaget eller endnu ikke er syntetiseret..
Det giver information og data om grupperne, grundstoffer, atommasse, ioniseringsenergi, elektronisk konfiguration, atomnummer, elektronegativitet og oxidationstilstande. Det periodiske system giver også en nyttig ramme til analyse af kemisk adfærd; Det er meget brugt inden for kemi og i mange andre videnskaber.
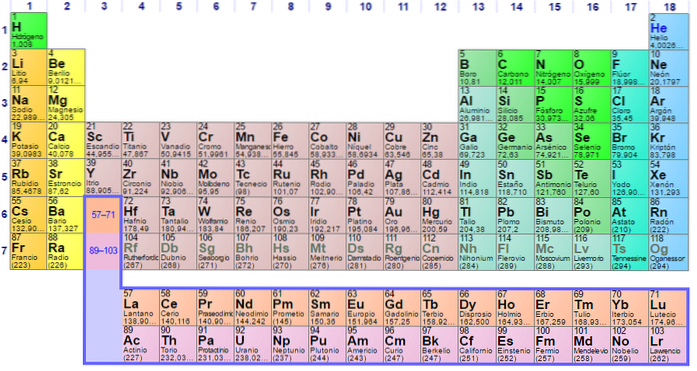
Det blev bygget i 1869 af den russiske videnskabsmand Dmitri Ivanovich Mendeleev for at visualisere de forskellige sammenhænge mellem de forskellige kemiske elementer.
Det periodiske system er ordnet efter dets atomnummer, elektronkonfigurationer og tilbagevendende kemiske egenskaber. Det er også ordnet, så genstande med lignende adfærd er i samme kolonne.
Tabellen har fire rektangulære blokke med lignende kemiske egenskaber. Generelt er elementerne placeret på venstre side af en række metaller, og de ikke-metaller er placeret til højre.
Elementer er placeret på det periodiske system baseret på deres atomare struktur. Hver række og hver kolonne har særlige egenskaber.
Alle rækkerne i tabellen læses fra venstre mod højre, og hver række kaldes en periode. Hver kolonne i tabellen kaldes en gruppe. Hver gruppe i tabellen har det samme antal elektroner.
Det er let at finde antallet af elektroner i den ydre skal af hvert element i tabellen. Gruppe en har en elektron, gruppe to har to osv.
En god periodisk tabel er et godt værktøj til problemløsning inden for kemi. Periodiske tabeller kan findes på Internettet, eller de kan udskrives.
Anvendelse af det periodiske system, hvad det er beregnet til?
Kend symbolet på det kemiske element
Symboler er stenografi for varens navn. I mange tilfælde kommer forkortelsen fra det originale latinske navn.
Hvert symbol har en eller to bogstaver som en forkortelse. Normalt er symbolet en forkortelse af elementets navn, men nogle symboler henviser til de gamle navne på elementerne.
Et eksempel på denne sag er sølv; dets symbol er Ag, der henviser til dets gamle navn, der var argentum.
Kend elementets atomnummer
Dette er antallet af protoner, som et atom af dette element indeholder. Antallet af protoner er den afgørende faktor, når det kommer til at skelne et element fra det andet. Variationen i antallet af elektroner eller neutroner ændrer ikke typen af element.
Ændrende antal elektroner producerer ioner, mens ændringer i antallet af neutroner producerer isotoper. Det moderne periodiske system er arrangeret i stigende rækkefølge efter atomnummer.
Identificer hvad perioderne og grupperne i det periodiske system betyder
De vandrette rækker kaldes perioder. Hver periode indikerer det højeste niveau af energi, som hver af elektronerne i dette element indtager i sin basistilstand..
De lodrette søjler kaldes grupper. Hvert element i en gruppe har det samme valenselektronnummer, og de opfører sig typisk på en lignende måde, når de er relateret til andre elementer..
De sidste to rækker, lanthaniderne og actiniderne, hører til gruppe 3B og er angivet separat..
Kend elementets navn
Mange periodiske tabeller inkluderer også det fulde navn på varen. Dette er nyttigt, når det kommer til at kende et element, da du ikke altid kan huske symbolerne på alle elementerne.
Bliv fortrolig med elementets atommasse i atommasseenheder
Dette tal henviser til den gennemsnitlige tunge masse af et kemisk grundstofs isotoper. Mendeleevs oprindelige periodiske system var organiseret, så elementerne blev vist i stigende rækkefølge af atommasse eller vægt..
Identificer elementtyperne
Mange periodiske tabeller identificerer forskellige typer af elementer ved at bruge forskellige farver til forskellige typer af elementer.
Disse typer inkluderer alkalimetaller, uædle metaller, overgangsmetaller, ikke-metaller, ædle gasser, allogener, jordalkalier, halvmetaller, actinider og lanthanider..
Vis de forskellige tendenser (periodicitet)
Det periodiske system er organiseret til at vise de forskellige typer tendens (periodicitet). Mellem dem:
- Atomradien, som er halvdelen af afstanden mellem centrene på to atomer, der næppe rører hinanden:
- Det øges, når du bevæger dig fra toppen til bunden af det periodiske system.
- Den falder ned, når den bevæger sig fra venstre mod højre gennem det periodiske system.
- Ioniseringsenergi, som er den energi, der kræves for at fjerne en elektron fra atomet.
- Det falder ned, når det bevæger sig op og ned i det periodiske system.
- Stiger, når du bevæger dig fra venstre til højre på det periodiske system.
- Elektronegativitet, som måler evnen til at danne en kemisk binding.
- Den falder ned, når den bevæger sig op og ned.
- Stiger, når du bevæger dig fra venstre til højre.
- Elektronaffinitet, der henviser til elementets evne til at acceptere en elektron.
Elektronaffinitet kan forudsiges ud fra grupperne af elementerne. Ædle gasser, såsom argon og neon, har næsten nul elektronaffinitet og har tendens til ikke at acceptere elektroner..
Halogener, som klor og iod, har høje elektronaffiniteter. De fleste andre grupper af grundstoffer har elektronaffiniteter, der er lavere end for allogener, men meget højere end for ædle gasser..
Referencer
- Hvad er formålet med det periodiske system? Gendannet fra reference.com
- Sådan bruges et periodisk system (2017) Gendannet fra thoughtco.com
- Hvordan er elementerne i det periodiske system organiseret? Gendannet fra reference.com
- Periodiske system. Gendannet fra wikipeda.org
- Hvorfor er det periodiske system nyttigt? Gendannet fra reference.com



Endnu ingen kommentarer