
Ammoniumion (NH4 +) formel, egenskaber og anvendelser

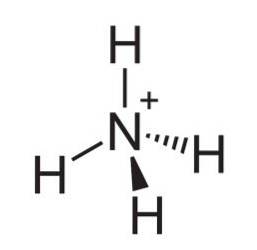
Det ammoniumion er en positivt ladet polyatomisk kation, hvis kemiske formel er NH4+. Molekylet er ikke fladt, men er formet som en tetraeder. De fire hydrogenatomer udgør de fire hjørner.
Ammoniaknitrogen har et ikke-delt par elektroner, der er i stand til at acceptere en proton (Lewis-base), hvorfor ammoniumionen dannes ved protonering af ammoniak ifølge reaktionen: NH3 + H+ → NH4+
Navnet ammonium gives også til substituerede aminer eller substituerede ammoniumkationer. For eksempel er methylammoniumchlorid et ionisk salt med formlen CH3NH4Cl hvor chloridionen er bundet til en methylamin.
Ammoniumionen har egenskaber, der minder meget om de tungere alkalimetaller og betragtes ofte som en nær slægtning. Ammonium forventes at opføre sig som et metal ved meget høje tryk, såsom inde i gaskæmpeplaneter som Uranus og Neptun..
Ammoniumionen spiller en vigtig rolle i proteinsyntese i menneskekroppen. Kort sagt har alle levende ting brug for proteiner, der består af ca. 20 forskellige aminosyrer. Mens planter og mikroorganismer kan syntetisere de fleste aminosyrer fra nitrogen i atmosfæren, kan dyr ikke..
For mennesker kan nogle aminosyrer slet ikke syntetiseres og skal indtages som essentielle aminosyrer.
Andre aminosyrer kan imidlertid syntetiseres af mikroorganismer i mave-tarmkanalen ved hjælp af ammoniakioner. Dette molekyle er således en nøglefigur i nitrogencyklussen og i proteinsyntese..
Artikelindeks
- 1 egenskaber
- 1.1 Opløselighed og molekylvægt
- 1.2 Syre-base egenskaber
- 1.3 Ammoniumsalte
- 2 anvendelser
- 3 Referencer
Ejendomme
Opløselighed og molekylvægt
Ammoniumionen har en molekylvægt på 18,039 g / mol og en opløselighed på 10,2 mg / ml vand (National Center for Biotechnology Information, 2017). Opløsning af ammoniak i vand danner ammoniumionen ifølge reaktionen:
NH3 + HtoO → NH4+ + Åh-
Dette øger hydroxylkoncentrationen i mediet ved at øge pH i opløsningen (Royal Society of Chemistry, 2015).
Syrebaseegenskaber
Ammoniumionen har en pKb på 9,25. Dette betyder, at det ved pH højere end denne værdi vil have en syreadfærd, og ved lavere pH vil det have en grundlæggende adfærd..
For eksempel, når ammoniak opløses i eddikesyre (pKa = 4,76), tager det frie elektronpar af nitrogen en proton fra mediet, hvilket øger koncentrationen af hydroxidioner i henhold til ligningen:
NH3 + CH3COOH ⇌ NH4+ + CH3COO-
Imidlertid giver ammoniumionen i nærværelse af en stærk base, såsom natriumhydroxid (pKa = 14,93), en proton til mediet ifølge reaktionen:
NH4+ + NaOH ⇌ NH3 + Na+ + HtoELLER
Afslutningsvis vil nitrogen ved pH mindre end 9,25 blive protoneret, mens det ved pH større end denne værdi deprotoneres. Dette er af største vigtighed for at forstå titreringskurver og forstå opførsel af stoffer såsom aminosyrer..
Ammoniumsalte
En af de mest karakteristiske egenskaber ved ammoniak er dens evne til at kombinere direkte med syrer for at danne salte afhængigt af reaktionen:
NH3 + HX → NH4x
Således danner den med saltsyre ammoniumchlorid (NH4Cl); Med salpetersyre, ammoniumnitrat (NH4IKKE3), med kulsyre vil det danne ammoniumcarbonat ((NH4)toCO3) etc.
Det er vist, at perfekt tør ammoniak ikke kombineres med perfekt tør saltsyre, idet fugtigheden er nødvendig for at forårsage reaktionen (VIAS Encyclopedia, 2004).
De fleste enkle ammoniumsalte er meget opløselige i vand. En undtagelse er ammoniumhexachloroplatinat, hvis dannelse anvendes som en test for ammonium. Saltene af ammoniumnitrat og især perchlorat er meget eksplosive, i disse tilfælde er ammonium reduktionsmidlet.
I en usædvanlig proces danner ammoniumionerne et amalgam. Sådanne arter fremstilles ved elektrolyse af en ammoniumopløsning ved anvendelse af en kviksølvkatode. Denne amalgam nedbrydes til sidst for at frigive ammoniak og brint (Johnston, 2014).
En af de mest almindelige ammoniumsalte er ammoniumhydroxid, som simpelthen er ammoniak opløst i vand. Denne forbindelse er meget almindelig og findes naturligt i miljøet (i luft, vand og jord) og i alle planter og dyr, inklusive mennesker..
Ansøgninger
Ammonium er en vigtig kvælstofkilde for mange plantearter, især dem der vokser i hypoxisk jord. Det er dog også giftigt for de fleste afgrødearter og anvendes sjældent som den eneste kvælstofkilde (Database, Human Metabolome, 2017).
Kvælstof (N), bundet til proteiner i død biomasse, forbruges af mikroorganismer og omdannes til ammoniumioner (NH4 +), der kan absorberes direkte af planterødder (f.eks. Ris).
Ammoniumioner omdannes normalt til nitritioner (NO2-) af nitrosomonas-bakterier efterfulgt af en anden omdannelse til nitrat (NO3-) af Nitrobacter-bakterier..
De tre vigtigste kvælstofkilder, der anvendes i landbruget, er urinstof, ammonium og nitrat. Den biologiske oxidation af ammonium til nitrat kaldes nitrifikation. Denne proces involverer flere trin og formidles af obligatoriske aerobe, autotrofiske bakterier..
I oversvømmede jordarter er oxidation af NH4 + begrænset. Urea nedbrydes af enzymet urease eller hydrolyseres kemisk til ammoniak og CO2.
I ammonificeringstrinnet omdannes ammoniak ved at ammonificere bakterier til ammoniumionen (NH4 +). I det næste trin omdannes ammonium ved nitrificering af bakterier til nitrat (nitrifikation).
Denne meget mobile form for kvælstof absorberes oftest af planterødder såvel som mikroorganismer i jorden..
For at lukke kvælstofcyklussen omdannes nitrogengas i atmosfæren til biomasse kvælstof af Rhizobium-bakterier, der lever i rodvæv af bælgfrugter (for eksempel lucerne, ærter og bønner) og bælgfrugter (såsom alder). Azotobacter (Sposito, 2011).
Gennem ammonium (NH4 +) kan vandplanter absorbere og inkorporere kvælstof i proteiner, aminosyrer og andre molekyler. Høje koncentrationer af ammoniak kan øge væksten af alger og vandplanter.
Ammoniumhydroxid og andre ammoniumsalte anvendes i vid udstrækning til fødevareforarbejdning. Food and Drug Administration (FDA) forordninger siger, at ammoniumhydroxid er sikkert ("generelt anerkendt som sikkert" eller GRAS) som gærmiddel, pH-kontrolmiddel og efterbehandlingsmiddel. Overfladisk i mad.
Listen over fødevarer, hvor ammoniumhydroxid anvendes som et direkte fødevaretilsætningsstof, er omfattende og inkluderer bagværk, oste, chokolade, andre konfektureprodukter (f.eks. Slik) og buddinger. Ammoniumhydroxid bruges også som et antimikrobielt middel i kødprodukter.
Ammoniak i andre former (f.eks. Ammoniumsulfat, ammoniumalginat) anvendes i krydderier, sojaproteinisolater, snacks, syltetøj og gelé og ikke-alkoholholdige drikkevarer (PNA kaliumnitratforening, 2016).
Ammoniummåling anvendes i RAMBO-testen, især nyttig til diagnosticering af årsagen til acidose (Test-ID: RAMBO Ammonium, Random, Urine, S.F.). Nyrerne regulerer syreudskillelse og systemisk syre-base balance.
Ændring af mængden af ammoniak i urinen er en vigtig måde for nyrerne at gøre dette. Måling af niveauet af ammoniak i urinen kan give indsigt i årsagen til en syre-base balanceforstyrrelse hos patienter..
Niveauet af ammoniak i urinen kan også give en masse information om den daglige syreproduktion hos en given patient. Da det meste af den enkeltes syreindhold kommer fra indtaget protein, er mængden af ammoniak i urinen en god indikator for proteinindtag i kosten.
Målinger af urinammoniak kan være særligt nyttige til diagnose og behandling af patienter med nyresten:
- Høje niveauer af ammoniak i urinen og en lav urin-pH antyder løbende gastrointestinale tab. Disse patienter er i fare for urinsyre og calciumoxalatsten..
- Lidt ammoniak i urinen og urinens høje pH antyder nyre-tubulær acidose. Disse patienter er i fare for calciumphosphatsten.
- Patienter med calciumoxalat og calciumphosphatsten behandles ofte med citrat for at hæve urincitrat (en naturlig hæmmer af calciumoxalat og calciumphosphatkrystalvækst)..
Men da citrat metaboliseres til bicarbonat (en base), kan dette lægemiddel også øge urinens pH. Hvis pH i urinen er for høj ved citratbehandling, kan risikoen for calciumphosphatsten øges utilsigtet..
Overvågning af urin for ammoniak er en måde at titrere citratdosis og undgå dette problem. En god startdosis af citrat er ca. halvdelen af ammoniumudskillelsen i urinen (i mEq af hver).
Effekten af denne dosis på urinammonium-, citrat- og pH-værdier kan overvåges, og citratdosen justeres baseret på respons. Et fald i urin-ammoniak skal indikere, om det nuværende citrat er tilstrækkeligt til delvis (men ikke fuldstændigt) at modvirke den daglige syreindhold hos den givne patient..
Referencer
- Database, Human Metabolome. (2017, 2. marts). Viser metabocard til ammonium. Gendannet fra: hmdb.ca.
- Johnston, F. J. (2014). Ammoniumsalt. hentet fra accessscience: accessscience.com.
- National Center for Biotechnology Information. (2017, 25. februar). PubChem Compound Database; CID = 16741146. Hentet fra PubChem.
- PNA kaliumnitratforening. (2016). Nitrat (NO3-) versus ammonium (NH4 +). hentet fra kno3.org.
- Royal Society of Chemistry. (2015). Ammoniumion. Gendannet fra chemspider: chemspider.com.
- Sposito, G. (2011, 2. september). Jord. Gendannet fra encyklopædi britannica: britannica.com.
- Test-id: RAMBO ammonium, tilfældig, urin. (S.F.). Gendannet fra encyclopediamayomedicallaboratorie.com.
- VIAS Encyclopedia. (2004, 22. december). Ammoniumsalte. Gendannet fra encyklopædi vias.org.



Endnu ingen kommentarer