
Avogadros lovlige måleenheder og eksperimenter
Det Avogadros lov postulerer, at et lige stort volumen af alle gasser ved samme temperatur og tryk har det samme antal molekyler. Amadeo Avogadro, en italiensk fysiker, foreslog to hypoteser i 1811: den første siger, at elementerne i elementære gasser er sammen i molekyler i stedet for at eksistere som separate atomer, som John Dalton sagde..
Den anden hypotese siger, at lige store mængder gasser ved konstant tryk og temperatur har det samme antal molekyler. Avogadros hypotese relateret til antallet af molekyler i gasser blev først accepteret i 1858, da den italienske kemiker Stanislao Cannizaro byggede et logisk kemisk system baseret på dette.

Følgende kan udledes af Avogadros lov: for en given masse af en ideel gas er dens volumen og antallet af molekyler direkte proportionale, hvis temperaturen og trykket er konstant. Dette indebærer også, at det molære volumen af gasser, der opfører sig ideelt, er det samme for alle.
For eksempel, givet et antal balloner mærket A til Z, fyldes de alle sammen, indtil de pustes op til et volumen på 5 liter. Hvert bogstav svarer til en anden gasformig art; det vil sige, dets molekyler har deres egne egenskaber. Avogadros lov siger, at alle balloner rummer det samme antal molekyler.
Hvis ballonerne nu pustes op til 10 liter, ifølge Avogadros hypoteser, vil dobbelt så mange indledende luftformige mol være blevet introduceret.
Artikelindeks
- 1 Hvad den består af og måleenheder
- 1.1 Fradrag af værdien af R, når den udtrykkes i L atm / K mol
- 2 Almindelig form for Avogadros lov
- 3 Konsekvenser og implikationer
- 4 oprindelser
- 4.1 Avogadros hypotese
- 4.2 Avogadros nummer
- 5 Avogadros eksperiment
- 5.1 Eksperiment med kommercielle containere
- 6 eksempler
- 6,1 O2 + 2H2 => 2H2O
- 6,2 N2 + 3H2 => 2NH3
- 6,3 N2 + O2 => 2NO
- 7 Referencer
Hvad det består af og måleenheder
Avogadros lov siger, at for en masse af en ideel gas er volumenet af gas og antallet af mol direkte proportionale, hvis temperaturen og trykket er konstant. Matematisk kan det udtrykkes med følgende ligning:
V / n = K
V = gasens volumen, generelt udtrykt i liter.
n = mængden af stoffet målt i mol.
Også fra den såkaldte idealgaslov har vi følgende:
PV = nRT
P = gastryk udtrykkes normalt i atmosfærer (atm), i mm kviksølv (mmHg) eller i Pascal (Pa).
V = gasens volumen udtrykt i liter (L).
n = antal mol.
T = temperaturen på gassen udtrykt i grader Celsius, grader Fahrenheit eller grader Kelvin (0 ºC svarer til 273,15 K).
R = den universelle konstant af ideelle gasser, som kan udtrykkes i forskellige enheder, blandt hvilke følgende skiller sig ud: 0,08205 L atm / K. mol (L atm K-1.muldvarp-1); 8,314 J / K. mol (J.K-1.muldvarp-1) (J er joule); og 1.987 cal / Kmol (cal.K-1.muldvarp-1) (cal er kalorier).
Fradrag af værdien af R udtrykt i LPengeautomat / KMuldvarp
Det volumen, som en mol af en gas optager ved en trykatmosfære og 0 ºC svarende til 273K, er 22.414 liter.
R = PV / T
R = 1 atm x 22.414 (L / mol) / (273 ºK)
R = 0,082 L atm / mol.K
Den ideelle gasligning (PV = nRT) kan skrives som følger:
V / n = RT / P
Hvis temperatur og tryk antages at være konstante, fordi R er en konstant, så:
RT / P = K
Senere:
V / n = K
Dette er en konsekvens af Avogadros lov: eksistensen af et konstant forhold mellem det volumen, som en ideel gas optager, og antallet af mol af den gas, til en konstant temperatur og et tryk..
Almindelig form for Avogadros lov
Hvis du har to gasser, bliver ovenstående ligning følgende:
V1/ n1= Vto/ nto
Dette udtryk er også skrevet som:
V1/ Vto= n1/ nto
Ovenstående viser det angivne proportionalitetsforhold.
I sin hypotese påpegede Avogadro, at to ideelle gasser i samme volumen og ved samme temperatur og tryk indeholder det samme antal molekyler.
I forlængelse gælder det samme for ægte gasser; for eksempel et lige volumen af Oto og Nto indeholder det samme antal molekyler, når det har samme temperatur og tryk.
Reelle gasser viser små afvigelser fra den ideelle opførsel. Imidlertid er Avogadros lov tilnærmelsesvis gyldig for ægte gasser ved lavt nok tryk og ved høje temperaturer.
Konsekvenser og implikationer
Den mest betydningsfulde konsekvens af Avogadros lov er, at den konstante R for ideelle gasser har den samme værdi for alle gasser.
R = PV / nT
Så hvis R er konstant for to gasser:
P1V1/ nT1= PtoVto/ ntoTto = konstant
Suffikser 1 og 2 repræsenterer to forskellige ideelle gasser. Konklusionen er, at den ideelle gaskonstant for 1 mol af en gas er uafhængig af gassens art. Derefter vil volumenet optaget af denne mængde gas ved en given temperatur og et tryk altid være det samme.
En konsekvens af anvendelsen af Avogadros lov er konstateringen af, at 1 mol af en gas optager et volumen på 22.414 liter ved et tryk på 1 atmosfære og en temperatur på 0 ºC (273K).
En anden åbenbar konsekvens er følgende: hvis tryk og temperatur er konstante, når mængden af en gas øges, øges dens volumen også..
oprindelse
I 1811 fremsatte Avogadro sin hypotese baseret på Daltons atomteori og Gay-Lussacs lov om molekylers bevægelsesvektorer..
Gay-Lussac konkluderede i 1809, at "gasser, uanset hvilke proportioner de kan kombineres, altid giver anledning til forbindelser, hvis elementer målt i volumen altid er multipla af en anden".
Den samme forfatter viste også, at "gaskombinationer altid finder sted efter meget enkle volumenforhold".
Avogadro påpegede, at kemiske reaktioner i gasfasen involverer molekylære arter af både reaktanter og produkt.
Ifølge denne erklæring skal forholdet mellem reaktanten og produktmolekylerne være et heltal, da eksistensen af bindingsbrud før reaktionen (individuelle atomer) ikke er sandsynlig. Molære mængder kan dog udtrykkes med brøkværdier.
Loven om kombinationsvolumener angiver for sin del, at det numeriske forhold mellem de gasformige volumener også er simpelt og heltal. Dette resulterer i en direkte sammenhæng mellem volumener og antallet af molekyler i den gasformige art..
Avogadro hypotese
Avogadro foreslog, at gasmolekyler var diatomiske. Dette forklarede, hvordan to volumener molekylært brint kombineres med et volumen molekylært ilt for at give to volumener vand..
Desuden foreslog Avogadro, at hvis lige store volumener af gasser indeholdt det samme antal partikler, skulle forholdet mellem densiteten af gasserne være lig med forholdet mellem molekylmasserne af disse partikler..
At dividere d1 med d2 giver naturligvis anledning til kvotienten m1 / m2, da volumenet optaget af de gasformige masser er det samme for begge arter, og det annulleres:
d1 / d2 = (m1 / V) / (m2 / V)
d1 / d2 = m1 / m2
Avogadros nummer
En muldvarp indeholder 6,022 x 102. 3 molekyler eller atomer. Dette tal kaldes Avogadros nummer, skønt han ikke var den, der beregnede det. Jean Pierre, nobelprisvinderen fra 1926, foretog de tilsvarende målinger og foreslog navnet til ære for Avogadro.
Avogadros eksperiment
En meget enkel demonstration af Avogadros lov består i at placere eddikesyre i en glasflaske og derefter tilsætte natriumbicarbonat, lukke munden på flasken med en ballon, der forhindrer ind- eller udgang af en gas inde i flasken.
Eddikesyre reagerer med natriumbicarbonat og frigiver således COto. Gassen akkumuleres i ballonen og forårsager dens inflation. Teoretisk set er volumenet, der nås af ballonen, proportionalt med antallet af CO-molekylerto, som anført i Avogadros lov.
Imidlertid har dette eksperiment en begrænsning: ballonen er en elastisk krop; derfor, når væggen strækker sig på grund af akkumulering af COto, der genereres en kraft i denne, der modsætter sig dens udspænding og forsøger at reducere volumenet af ballonen.
Eksperimenter med kommercielle containere
Et andet illustrativt eksperiment med Avogadros lov præsenteres med brugen af sodavand og plastflasker..
I tilfælde af sodavand hældes bagepulver i den, og derefter tilsættes en citronsyreopløsning. Forbindelserne reagerer med hinanden og producerer frigivelse af CO-gasto, der akkumuleres inde i dåsen.
Derefter tilsættes en koncentreret natriumhydroxidopløsning, som har funktionen at "sekvestrere" CO.to. Adgang til indersiden af dåsen lukkes derefter hurtigt ved hjælp af maskeringstape.
Efter en vis tid observeres det, at dåsen trækker sig sammen, hvilket indikerer, at tilstedeværelsen af CO er faldet.to. Derefter kunne man tro, at der er et fald i dåsen, der svarer til et fald i antallet af CO-molekyler.to, ifølge Avogadros lov.
I eksperimentet med flasken følges den samme procedure som med sodavand, og når NaOH tilsættes, lukkes flaskens mund med låget; ligeledes observeres en sammentrækning af flaskens væg. Som et resultat kan den samme analyse udføres som i tilfælde af sodavand..
Eksempler
De tre billeder nedenfor illustrerer konceptet med Avogadros lov, der vedrører det volumen, som gasser optager, og antallet af molekyler af reaktanter og produkter..
ELLERto + 2Hto => 2HtoELLER
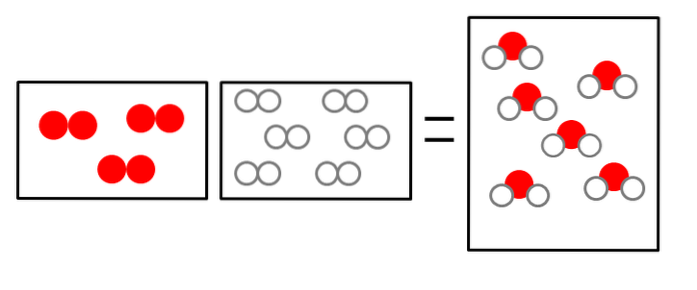
Volumenet af brintgas er dobbelt, men det optager en beholder af samme størrelse som gasformigt ilt.
Nto + 3Hto => 2NH3
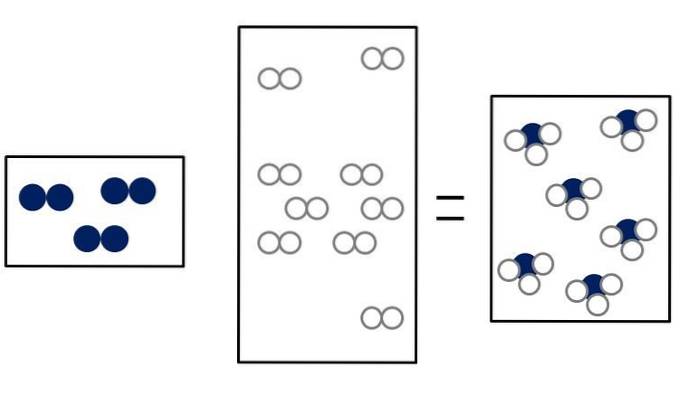
Nto + ELLERto => 2NO

Referencer
- Bernard Fernandez, ph.d. (Februar 2009). To hypoteser om Avogadro (1811). [PDF]. Hentet fra: bibnum.education.fr
- Nuria Martínez Medina. (5. juli 2012). Avogadro, den store italienske videnskabsmand i det 19. århundrede. Hentet fra: rtve.es
- Muñoz R. og Bertomeu Sánchez J.R. (2003) Videnskabshistorie i lærebøger: Avogadros hypotese (r), Undervisningsvidenskab, 21 (1), 147-161.
- Helmenstine, Anne Marie, Ph.D. (1. februar 2018). Hvad er Avogadros lov? Hentet fra: thoughtco.com
- Redaktørerne af Encyclopaedia Britannica. (2016, 26. oktober). Avogadros lov. Encyclopædia Britannica. Hentet fra: britannica.com
- Yang, S. P. (2002). Husholdningsprodukter, der bruges til at kollapse tætte containere og demonstrere Avogadros lov. Kemisk pædagog. Bind: 7, sider: 37-39.
- Glasstone, S. (1968). Traktaten om fysisk kemi. togiver Ed. Redaktionel Aguilar.



Endnu ingen kommentarer