
Beer-Lambert lovansøgninger og løste øvelser
Det Beer-Lambert-loven (Beer-Bouguer) er en, der relaterer absorptionen af elektromagnetisk stråling fra en eller flere kemiske arter med dens koncentration og afstanden, som lyset bevæger sig i partikel-foton-interaktioner. Denne lov samler to love i en.
Bougues lov (selvom anerkendelsen er faldet mere på Heinrich Lambert), fastslår, at en prøve vil absorbere mere stråling, når dimensionerne på det absorberende medium eller materiale er større; specifikt dens tykkelse, som er afstanden l at lyset bevæger sig, når det kommer ind og ud.
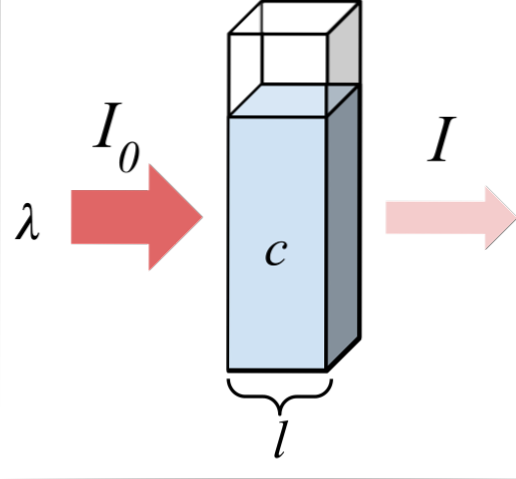
Det øverste billede viser absorptionen af monokromatisk stråling; det vil sige, består af en enkelt bølgelængde, λ. Det absorberende medium er inde i en optisk celle, hvis tykkelse er l, og indeholder kemiske arter med en koncentration c.
Lysstrålen har en indledende og endelig intensitet, betegnet med symbolerne I0 og hhv. Bemærk, at efter interaktion med det absorberende medium er jeg mindre end jeg0, hvilket viser, at der var absorption af stråling. Jo ældre de er c Y l, mindre vil jeg være med hensyn til jeg0; der vil være mere absorption og mindre transmission.
Artikelindeks
- 1 Hvad er Beer-Lambert-loven?
- 1.1 Absorbans og transmission
- 1.2 Grafik
- 2 applikationer
- 3 Løst øvelser
- 3.1 Øvelse 1
- 3.2 Øvelse 2
- 4 Referencer
Hvad er Beer-Lambert-loven?
Billedet ovenfor omfatter perfekt denne lov. Absorptionen af stråling i en prøve øges eller formindskes eksponentielt som en funktion af c eller l. For fuldt ud og let at forstå loven er det nødvendigt at sætte bund på dens matematiske aspekter.
Som netop nævnt, jeg0 og jeg er intensiteterne af den monokromatiske lysstråle henholdsvis før og efter lyset. Nogle tekster foretrækker at bruge symbolerne P0 og P, der refererer til strålingens energi og ikke til dens intensitet. Her fortsættes forklaringen ved hjælp af intensiteterne.
For at linearisere ligningen af denne lov skal logaritmen anvendes, generelt basen 10:
Log (I0/ I) = εlc
Udtrykket (I0/ I) angiver, hvor meget intensiteten af absorptionens stråleprodukt falder. Lamberts lov betragter kun l (εl), mens Beer's lov ignorerer l, men placerer c i stedet (εc). Den øvre ligning er foreningen af begge love og er derfor det generelle matematiske udtryk for Beer-Lambert-loven.
Absorbans og transmission
Absorbansen defineres ved udtrykket Log (I0/ I). Ligningen udtrykkes således som følger:
A = εlc
Hvor ε er ekstinktionskoefficienten eller molær absorptionsevne, som er en konstant ved en given bølgelængde.
Bemærk, at hvis tykkelsen af det absorberende medium holdes konstant, ligesom ε, vil absorbansen A kun afhænge af koncentrationen c, af absorberende arter. Det er også en lineær ligning, y = mx, hvor Y er A, og x det er c.
Når absorbansen øges, aftager transmittansen; det vil sige hvor meget stråling, der formår at blive transmitteret efter absorption. De er derfor omvendte. Ja jeg0/ I angiver graden af absorption, I / I0 er lig med transmission. At vide dette:
Jeg / jeg0 = T
(JEG0/ I) = 1 / T
Log (I0/ I) = Log (1 / T)
Men, Log (I0/ I) er også lig med absorbans. Så forholdet mellem A og T er:
A = Log (1 / T)
Og anvendelse af logaritmernes egenskaber og at vide, at Log1 er lig med 0:
A = -LogT
Transmittanser udtrykkes normalt i procent:
% T = I / I0∙ 100
Diagrammer
Som tidligere nævnt svarer ligningerne til en lineær funktion; det forventes derfor, at når de tegner et diagram, vil de give en linje.
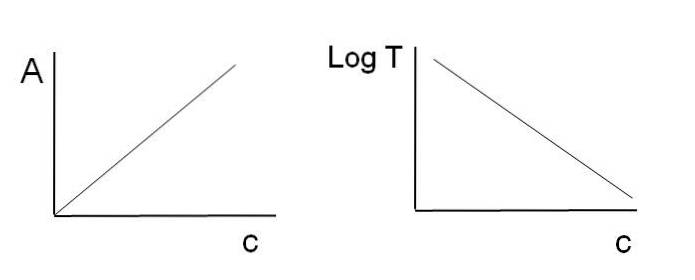
Bemærk, at til venstre for billedet ovenfor er linjen opnået ved at tegne A mod c, og til højre den linje, der svarer til grafen for LogT mod c. Den ene har en positiv hældning, og den anden negativ; jo højere absorbans, jo lavere transmittans.
Takket være denne linearitet kan koncentrationen af de absorberende kemiske arter (kromoforer) bestemmes, hvis det vides, hvor meget stråling de absorberer (A), eller hvor meget stråling der transmitteres (LogT). Når denne linearitet ikke overholdes, siges det, at den står over for en afvigelse, positiv eller negativ, af Beer-Lambert-loven.
Ansøgninger
Generelt er nogle af de vigtigste anvendelser af denne lov nævnt nedenfor:
-Hvis en kemisk art viser farve, er det en eksemplarisk kandidat, der skal analyseres ved hjælp af kolorimetriske teknikker. Disse er baseret på Beer-Lambert-loven og gør det muligt at bestemme analytternes koncentration som en funktion af absorbanserne opnået med et spektrofotometer..
-Det muliggør konstruktion af kalibreringskurver, hvormed koncentrationen af arten af interesse bestemmes under hensyntagen til matrixeffekten af prøven.
-Det bruges i vid udstrækning til at analysere proteiner, da flere aminosyrer har signifikante absorptioner i den ultraviolette region i det elektromagnetiske spektrum..
-Kemiske reaktioner eller molekylære fænomener, der involverer en farveændring, kan analyseres ved hjælp af absorbansværdier ved en eller flere bølgelængder..
-Ved hjælp af multivariat analyse kan komplekse blandinger af kromoforer analyseres. På denne måde kan koncentrationen af alle analytter bestemmes, og blandingerne kan også klassificeres og differentieres fra hinanden; for eksempel at udelukke, om to identiske mineraler kommer fra det samme kontinent eller det specifikke land.
Løst øvelser
Øvelse 1
Hvad er absorbansen af en opløsning, der udviser en transmittans på 30% ved en bølgelængde på 640 nm??
For at løse det skal du bare gå til definitionerne af absorbans og transmission.
% T = 30
T = (30/100) = 0,3
Og at vide, at A = -LogT, beregningen er ligetil:
A = -Log 0,3 = 0,5228
Bemærk, at den mangler enheder.
Øvelse 2
Hvis løsningen fra den foregående øvelse består af en art W, hvis koncentration er 2,30 ∙ 10-4 M, og forudsat at cellen er 2 cm tyk: hvad skal dens koncentration være for at opnå en transmission på 8%??
Det kunne løses direkte med denne ligning:
-LogT = εlc
Men værdien af ε er ukendt. Derfor skal det beregnes med de tidligere data, og det antages, at det forbliver konstant over en lang række koncentrationer:
ε = -LogT / lc
= (-Log 0,3) / (2 cm x 2,3 ∙ 10-4 M)
= 1136,52 M-1∙ cm-1
Og nu kan du gå videre til beregningen med% T = 8:
c = -LogT / εl
= (-Log 0,08) / (1136,52 M-1∙ cm-1 x 2 cm)
= 4,82 ∙ 10-4 M
Derefter er det nok for W-arten at fordoble sin koncentration (4,82 / 2,3) for at reducere dens transmittansprocent fra 30% til 8%..
Referencer
- Day, R., & Underwood, A. (1965). Kvantitativ analytisk kemi. (femte udgave). PEARSON Prentice Hall, s 469-474.
- Skoog D.A., West D.M. (1986). Instrumental analyse. (anden udgave). Interamericana., Mexico.
- Soderberg T. (18. august 2014). Beer-Lambert-loven. Kemi LibreTexts. Gendannet fra: chem.libretexts.org
- Clark J. (maj 2016). Beer-Lambert-loven. Gendannet fra: chemguide.co.uk
- Kolorimetrisk analyse: Ølens lov eller spektrofotometrisk analyse. Gendannet fra: chem.ucla.edu
- Dr. J.M. Fernandez Alvarez. (s.f.). Analytisk kemi: manual til løste problemer. [PDF]. Gendannet fra: dadun.unav.edu

Endnu ingen kommentarer