
Molær masse, hvordan man beregner den, eksempler og løste øvelser
Det Molar masse er en intensiv ejendom af stof, der relaterer begrebet en muldvarp til målinger af masse. At være mere kortfattet, det er den mængde masse, der svarer til en mol stof; det vil sige, hvad et Avogadro-nummer "vejer", (6.022 · 102. 3) af bestemte partikler.
En mol af ethvert stof vil indeholde det samme antal partikler (ioner, molekyler, atomer osv.); dens masse vil imidlertid variere, fordi dens molekylære dimensioner er defineret af antallet af atomer og de isotoper, der udgør dens struktur. Jo mere massivt atomet eller molekylet er, desto større er dets molære masse..
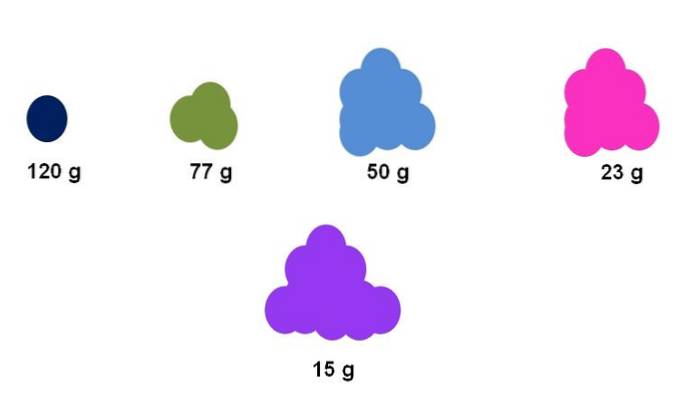
Antag for eksempel, at der indsamles nøjagtigt en mol til fem forskellige forbindelser (topbillede). Ved hjælp af en balance er massen for hver klynge, udtrykt nedenfor, blevet målt. Denne masse svarer til den molære masse. Af dem alle har den lilla forbindelse de lyseste partikler, mens den mørkeblå forbindelse har de tungeste partikler..
Bemærk, at der vises en generaliseret og overdrevet tendens: jo højere molær masse, jo mindre er mængden af prøve, der skal placeres på vægten. Imidlertid er denne mængde stof meget afhængig af tilstanden for sammenlægning af hver forbindelse og dens densitet..
Artikelindeks
- 1 Hvordan beregner man molmassen?
- 1.1 Definition
- 1.2 Elementer
- 1.3 Forbindelser
- 2 Eksempler
- 3 Løst øvelser
- 3.1 Øvelse 1
- 3.2 Øvelse 2
- 3.3 Øvelse 3
- 4 Referencer
Hvordan beregner man molmassen?

Definition
Molær masse kan beregnes ud fra dens definition: massemængde pr. Mol stof:
M = gram stof / mol stof
Faktisk er g / mol den enhed, i hvilken molær masse normalt udtrykkes sammen med kg / mol. Hvis vi ved, hvor mange mol vi har af en forbindelse eller et element, og vi vejer det, når vi således direkte til dets molære masse ved at anvende en simpel opdeling.
Elementer
Molær masse gælder ikke kun for forbindelser, men også for grundstoffer. Begrebet modermærker diskriminerer slet ikke. Derfor finder vi ved hjælp af et periodisk system de relative atommasser for et element af interesse, og vi gange dets værdi med 1 g / mol; dette er Avogadros konstant, MELLER.
For eksempel er den relative atommasse af strontium 87,62. Hvis vi vil have dets atommasse, ville den være 87,62 amu; men hvis det, vi leder efter, er dens molære masse, så vil den være 87,62 g / mol (87,62 · 1g / mol). Og således opnås de molære masser af alle de andre elementer på samme måde uden engang at skulle udføre multiplikationen..
Forbindelser
Den molære masse af en forbindelse er intet mere end summen af de relative atommasser af dets atomer ganget med MELLER.
For eksempel kan vandmolekylet, HtoEller den har tre atomer: to brint og et ilt. De relative atommasser af H og O er henholdsvis 1.008 og 15.999. Således tilføjer vi deres masser ved at gange med antallet af atomer til stede i forbindelsens molekyle:
2 H (1,008) = 2,016
1 O (15.999) = 15.999
M(HtoO) = (2.016 + 15.999) 1 g / mol = 18.015 g / mol
Det er en ret almindelig praksis at udelade MELLER til sidst:
M(HtoO) = (2.016 + 15.999) = 18.015 g / mol
Molmasse forstås at have enheder på g / mol.
Eksempler
En af de mest kendte molære masser er netop blevet nævnt: den af vand, 18 g / mol. De, der er fortrolige med disse beregninger, når et punkt, hvor de er i stand til at huske nogle molære masser uden at skulle lede efter dem eller beregne dem, som det blev gjort ovenfor. Nogle af disse molære masser, der tjener som eksempler, er følgende:
-ELLERto: 32 g / mol
-Nto: 28 g / mol
-NH3: 17 g / mol
-CH4: 16 g / mol
-COto: 44 g / mol
-HCI: 36,5 g / mol
-HtoSW4: 98 g / mol
-CH3COOH: 60 g / mol
-Fe: 56 g / mol
Bemærk, at de givne værdier er afrundede. For mere præcise formål skal de molære masser udtrykkes til flere decimaler og beregnes med de skyldige og nøjagtige relative atommasser.
Løst øvelser
Øvelse 1
Ved analytiske metoder blev det anslået, at en opløsning af en prøve indeholder 0,0267 mol af en analyt D. Det er også kendt, at dens masse svarer til 14% af en prøve, hvis samlede masse er 76 gram. Beregn den molære masse af den formodede analyt D..
Vi skal bestemme massen af D, der er opløst i opløsningen. Vi fortsætter:
Masse (D) = 76 g 0,14 = 10,64 g D
Det vil sige, vi beregner 14% af de 76 gram af prøven, der svarer til gram analyt D. Derefter og endelig anvender vi definitionen af molær masse, da vi har nok data til at beregne den:
M(D) = 10,64 g D / 0,0267 mol D.
= 398,50 g / mol
Hvilket oversættes som: en mol (6.022102. 3) af Y-molekyler har en masse lig med 398,50 gram. Takket være denne værdi kan vi vide, hvor meget af Y vi vil veje på vægten, hvis vi f.eks. Ønsker at fremstille en opløsning med en molær koncentration på 5 · 10-3 M; dvs. 0,1993 gram Y opløses i en liter opløsningsmiddel:
5 10-3 (mol / L) · (398,50 g / mol) = 0,1993 g Y
Øvelse 2
Beregn den molære masse af citronsyre ved at vide, at dens molekylformel er C6H8ELLER7.
Den samme formel C6H8ELLER7 Det letter forståelsen af beregningen, da den straks fortæller os antallet af C-, H- og O-atomer, der er i citronsyre. Derfor gentager vi det samme trin udført for vandet:
6 C · (12,0107) = 72,0642
8 H (1.008) = 8.064
7 O (15.999) = 111.993
M(citronsyre) = 72,0642 + 8,064 + 111,93
= 192,1212 g / mol
Øvelse 3
Beregn molmassen af kobbersulfatpentahydrat, CuSO45HtoELLER.
Vi ved fra før, at den molære masse af vand er 18.015 g / mol. Dette hjælper os med at forenkle beregningerne, da vi udelader det for øjeblikket og fokuserer på det vandfri salt CuSO4.
Vi har, at de relative atommasser af kobber og svovl er henholdsvis 63,546 og 32,065. Med disse data fortsætter vi på samme måde som med øvelse 2:
1 Cu (63,546) = 63,546
1 S (32.065) = 32.065
4 O (15.999) = 63.996
M(CuSO4) = 63.546 + 32.065 + 63.996
= 159,607 g / mol
Men vi er interesserede i den molære masse af det pentahydrerede salt, ikke det vandfrie. For at gøre dette skal vi tilføje den tilsvarende vandmasse til resultatet:
5 timertoO = 5 (18.015) = 90.075
M(CuSO45HtoO) = 159,607 + 90,075
= 249,682 g / mol
Referencer
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.
- Wikipedia. (2020). Molar masse. Gendannet fra: en.wikipedia.org
- Nissa Garcia. (2020). Hvad er molær masse? Definition, formel og eksempler. Undersøgelse. Gendannet fra: study.com
- Dr. Kristy M. Bailey. (s.f.). Stoichiometry Tutorial
Find Molar Mass. Gendannet fra: occc.edu - Helmenstine, Anne Marie, Ph.D. (2. december 2019). Molær masseeksempel Problem. Gendannet fra: thoughtco.com


Endnu ingen kommentarer