
Methyl- eller methylgruppe
Det methyl eller methylgruppe er en alkylsubstituent, hvis kemiske formel er CH3. Det er den enkleste af alle kulstofsubstituenter i organisk kemi, den har et enkelt kulstof og tre hydrogen; stammer fra metangas. Fordi det kun kan binde sig til et andet kulstof, indikerer dets position slutningen af en kæde, dens afslutning.
På billedet nedenfor er der en af de mange repræsentationer for denne gruppe. Kurverne til højre angiver det bag H-ledet3C- kan være et hvilket som helst atom eller substituent; en alkyl, R, aromatisk eller aryl, Ar eller en heteroatom eller funktionel gruppe, såsom OH eller Cl.

Når den funktionelle gruppe, der er bundet til methyl, er OH, har vi alkoholen methanol, CH3OH; og hvis det er Cl, har vi methylchlorid, CH3Cl. I den organiske nomenklatur betegnes det simpelthen som 'methyl' forud for antallet af dets position i den længste kulstofkæde.
Methylgruppen CH3 er let at identificere under belysning af organiske strukturer, især takket være carbon 13 nuklear magnetisk resonansspektroskopi (C NMR13). Fra det, efter stærke oxidationer, opnås COOH-syregrupper, der er en syntetisk vej til at syntetisere carboxylsyrer.
Artikelindeks
- 1 repræsentationer
- 2 Struktur
- 3 egenskaber
- 4 Reaktivitet
- 4.1 Oxidationer
- 4,2 ioner
- 4.3 Methyleringsreaktion
- 5 Referencer
Repræsentationer
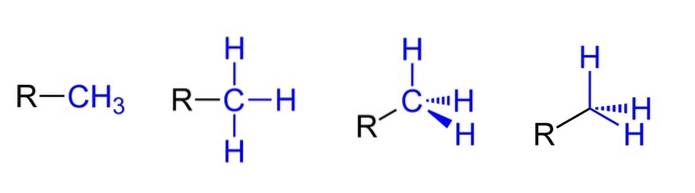
Ovenfor har vi de fire mulige repræsentationer forudsat at CH3 er bundet til en alkylsubstituent R. Alle er ækvivalente, men mens de går fra venstre til højre er de rumlige aspekter af molekylet tydelige.
For eksempel R-CH3 det giver indtryk af, at det er fladt og lineært. Den følgende repræsentation viser de tre C-H-kovalente bindinger, som gør det muligt at identificere methyl i en hvilken som helst Lewis-struktur og giver det falske indtryk af at være et kryds..
Derefter observeres SP-hybridiseringen ved at fortsætte til højre (næstsidste)3 på carbon af CH3 på grund af dens tetraedriske geometri. I den sidste repræsentation er det kemiske symbol for kulstof ikke engang skrevet, men tetraederne holdes for at indikere, hvilke H-atomer der er foran eller bag flyet..
Selvom det ikke er i billedet, er en anden meget tilbagevendende måde, når den repræsenterer CH3 den består i simpelthen at placere bindestreg (-) "nøgen". Dette er meget nyttigt ved tegning af store kulstofskeletter..
Struktur

Det øverste billede er den tredimensionelle repræsentation af det første. Den blanke sorte kugle svarer til kulstofatomet, mens de hvide er hydrogenatomer.
Igen har kulstof et tetraedrisk miljøprodukt af sin sp-hybridisering3, og som sådan er det en relativt voluminøs gruppe, med dens CR-bindingsrotationer sterisk hindret; det vil sige, det kan ikke rotere, fordi de hvide kugler ville forstyrre de elektroniske skyer i deres nærliggende atomer og føle deres afstødning.
Imidlertid kan CH-obligationer vibrere, ligesom CR-binding. Derfor CH3 er en gruppe af tetraedrisk geometri, der kan belyses (bestemmes, konstateres) ved infrarød stråling (IR) spektroskopi, som alle funktionelle grupper og carbonbindinger med heteroatomer.
Det vigtigste er imidlertid dens belysning ved C-NMR.13. Takket være denne teknik bestemmes den relative mængde methylgrupper, som gør det muligt at samle den molekylære struktur..
Generelt jo flere CH grupper3 har et molekyle, jo mere "klodset" eller ineffektivt er dets intermolekylære interaktioner; jo lavere er deres smelte- og kogepunkter. CH-grupper3, på grund af deres hydrogener “glider” de mod hinanden, når de nærmer sig eller rører ved.
Ejendomme
Methylgruppen er kendetegnet ved at være i det væsentlige hydrofob og apolar.
Dette skyldes, at deres CH-bindinger ikke er særlig polære på grund af den lave forskel mellem elektronegativiteterne af kulstof og brint; Desuden fordeler dens tetraedriske og symmetriske geometri sine elektrondensiteter næsten homogent, hvilket bidrager til et ubetydeligt dipolmoment..
I mangel af polaritet, CH3 Det "løber væk" fra vand og opfører sig som en hydrofob. Derfor, hvis det ses i et molekyle, vil det være kendt, at denne methylende ikke vil interagere effektivt med vand eller et andet polært opløsningsmiddel..
Et andet træk ved CH3 er dens relative stabilitet. Medmindre det atom, der er bundet til det, fjerner dets elektroniske densitet, forbliver det praktisk talt inert over for meget stærke sure medier. Det vil dog ses, at det kan deltage i kemiske reaktioner, hovedsageligt med hensyn til dets oxidation eller migration (methylering) til et andet molekyle.
Reaktivitet
Oxidationer
CH3 det er ikke fritaget for rustning. Dette betyder, at det er modtageligt for dannelse af bindinger med ilt, C-O, hvis det reagerer med stærke oxidationsmidler. Når det oxiderer, omdannes det til forskellige funktionelle grupper.
For eksempel giver dens første oxidation anledning til methiol- (eller hydroxymethyl) -gruppen, CHtoOH, en alkohol. Den anden afledes i formylgruppen, CHO (HC = O), et aldehyd. Og den tredje tillader endelig dens omdannelse til carboxylgruppen, COOH, en carboxylsyre.
Denne række oxidationer bruges til at syntetisere benzoesyre (HOOC-C6H5) fra toluen (H3DC6H5).
Ion
CH3 under mekanismen for nogle reaktioner kan det få øjeblikkelige elektriske ladninger. For eksempel, når methanol opvarmes i et meget stærkt syremedium, i det teoretiske fravær af nukleofiler (søgere af positive ladninger), methylkationen, CH3+, da CH-båndet er brudt3-OH og OH forlader med bindingens elektronpar.
Arten CH3+ det er så reaktivt, at det kun er bestemt i gasfasen, da det reagerer eller forsvinder ved den mindste tilstedeværelse af en nukleofil.
På den anden side CH3 en anion kan også opnås: methanid, CH3-, den enkleste carbanion af alle. Men som ch3+, dens tilstedeværelse er unormal og forekommer kun under ekstreme forhold.
Methyleringsreaktion
I methyleringsreaktionen overføres en CH3 til et molekyle uden at producere elektriske ladninger (CH3+ ej heller CH3-) i processen. For eksempel methyliodid, CH3I, er et godt methyleringsmiddel og kan erstatte O-H-bindingen i flere molekyler med en O-CH3.
I organisk syntese medfører dette ingen tragedie; men ja når hvad der er methyleret i overskud er de nitrogenholdige baser af DNA.
Referencer
- Morrison, R. T. og Boyd, R, N. (1987). Organisk kemi. 5. udgave. Redaktionel Addison-Wesley Interamericana.
- Carey F. (2008). Organisk kemi. (Sjette udgave). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organisk kemi. Aminer. (10. udgave.). Wiley plus.
- Rahul Gladwin. (23. november 2018). Methylering. Encyclopædia Britannica. Gendannet fra: britannica.com
- Danielle Reid. (2019). Methyl Group: Struktur & Formel. Undersøgelse. Gendannet fra: study.com
- Wikipedia. (2019). Methylgruppe. Gendannet fra: en.wikipedia.org



Endnu ingen kommentarer