
Koncentrerede løsningsfunktioner og eksempler

EN koncentreret opløsning Det er en, der indeholder en stor mængde opløst stof i forhold til den mængde, det kunne opløse; mens en fortyndet opløsning har en lav koncentration af opløst stof. En fortyndet opløsning kan fremstilles ud fra en koncentreret opløsning ved at tilsætte opløsningsmiddel til den eller, hvis det er muligt, ekstrahere opløst stof fra den..
Konceptet kan være relativt, da det, der definerer en koncentreret opløsning, er høje værdier i nogle af dens egenskaber; for eksempel har en ismarengs en høj koncentration af sukker, hvilket er bevist af sin søde smag.
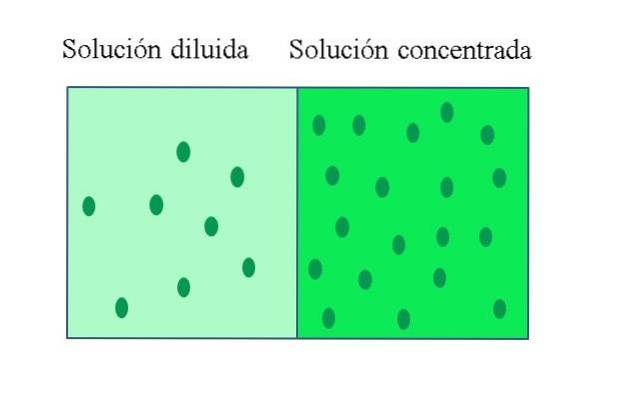
Opløsningskoncentrationen i en koncentreret opløsning er tæt på eller lig med en mættet opløsning. Hovedkarakteristikken ved en mættet opløsning er, at den ikke kan opløse en yderligere mængde opløst stof ved en bestemt temperatur. Derfor forbliver koncentrationen af det opløste stof i dets mættede opløsninger konstant..
Opløseligheden af de fleste opløste stoffer øges med stigende temperatur. På denne måde kan en yderligere mængde opløst stof opløses i en mættet opløsning..
Derefter øges den opløste koncentration af den mættede opløsning, når temperaturen falder. Taler i dette tilfælde om en overmættet løsning.
Artikelindeks
- 1 Karakteristisk for en koncentreret opløsning
- 2 Opløsnings kolligative egenskaber
- 2.1 Osmolaritet og osmolalitet
- 2.2 Damptryksreduktion
- 2.3 Nedstigning af det kryoskopiske punkt
- 2.4 Kogepunktshøjde
- 2.5 Osmotisk tryk
- 3 Forskelle med fortyndet opløsning
- 4 Eksempler på løsninger
- 4.1 Koncentreret
- 4.2 Fortyndet
- 5 Referencer
Karakteristisk for en koncentreret opløsning
Koncentrationen af en opløsning, dvs. forholdet mellem mængden af et opløst stof og mængden af en opløsning eller opløsningsmiddel, kan udtrykkes som en procentdel af opløst stof i opløsningen (P / V eller P / P).
Det kan også udtrykkes i mol opløst stof pr. Liter opløsning (molaritet) og opløste ækvivalenter pr. Liter opløsning (normalitet).
Ligeledes er det almindeligt at udtrykke koncentrationen af en opløsning i mol opløst stof pr. Kg af opløsningsmidlet (molalitet) eller at udtrykke det i mol af et opløst stof i forhold til det samlede antal mol af opløsningen (molær fraktion). I fortyndede opløsninger er det almindeligt at finde koncentrationen af en opløsning i p.p.m. (dele pr. million).
Uanset formen for ekspression af koncentrationen af en opløsning har en koncentreret opløsning en høj andel af det opløste stof, i dette tilfælde udtrykt som masse i forhold til massen eller volumenet af opløsningen eller opløsningsmidlet. Denne koncentration er lig med opløseligheden af det opløste stof i opløsningsmidlet eller meget tæt på dets værdi..
Colligative egenskaber ved løsninger
De er et sæt egenskaber af opløsninger, der afhænger af antallet af partikler i opløsningen uanset deres type.
De kolligative egenskaber skelner ikke mellem partiklernes egenskaber, hvad enten de er atomer af natrium, klor, glucose osv. Det vigtige er dit nummer.
På grund af dette faktum blev det nødvendigt at skabe en anden måde at udtrykke koncentrationen af en løsning, der er relateret til de såkaldte kolligative egenskaber. Som svar på dette blev udtrykkene osmolaritet og osmolalitet skabt.
Osmolaritet og osmolalitet
Osmolaritet er relateret til opløsningens molaritet og osmolalitet til dens molalitet..
Enhederne af osmolaritet er osm / L opløsning eller mosm / L opløsning. Mens enhederne af osmolalitet er osm / kg vand eller mosm / kg vand.
Osmolaritet = mvg
m = opløsningens opløsning.
v = antal partikler, i hvilke en forbindelse dissocieres i vandig opløsning. For eksempel: for NaCl har v en værdi på 2; for CaClto, v har en værdi på 3 og for glucose, en elektrolytisk forbindelse, der ikke adskiller sig, har v en værdi på 1.
g = osmotisk koefficient, korrektionsfaktor for interaktion mellem elektrisk ladede partikler i opløsning. Denne korrektionsfaktor har en værdi tæt på 1 for fortyndede opløsninger og har tendens til nul, når elektrolytforbindelseens molaritet øges..
De kolligative egenskaber er nævnt nedenfor, som gør det muligt at bestemme, hvor meget en opløsning er koncentreret.
Damptryksreduktion
Når vandet opvarmes, fordamper det, og den dannede damp udøver et tryk. Når der tilsættes opløst stof, falder damptrykket.
Derfor har koncentrerede opløsninger et lavt damptryk. Forklaringen er, at opløste molekyler fortrænger vandmolekyler ved vand-luft-grænsefladen..
Kryoskopisk punktstigning
Når en opløsnings osmolaritet øges, falder temperaturen, ved hvilken den vandige opløsning fryser. Hvis frysetemperaturen for rent vand er 0 ° C, bliver frysetemperaturen for en koncentreret vandig opløsning lavere end denne værdi..
Kogepunktshøjde
Ifølge Raoults lov er forhøjelsen af det rene opløsningsmiddels kogepunkt direkte proportional med molariteten af opløsningen, der stammer fra tilsætningen af opløst stof. Derfor har koncentrerede opløsninger et højere kogepunkt end vand..
Osmotisk tryk
Der er to rum med forskellige koncentrationer, adskilt af en membran, der tillader vand at passere igennem, men begrænser passage af opløste partikler..
Vandet flyder fra opløsningen med den laveste koncentration af opløst stof til opløsningen med den højeste koncentration af opløst stof.
Denne nettostrøm af vand forsvinder gradvist, da det akkumulerede vand i rummet med den højeste koncentration genererer et hydrostatisk tryk, der modsætter strømmen af vand ind i dette rum..
Vandstrømmen ved osmose forekommer generelt mod koncentrerede opløsninger.
Forskelle med fortyndet opløsning
-Koncentrerede opløsninger har en høj andel af opløst stof i forhold til opløsningens volumen eller masse. Fortyndede opløsninger har en lav andel af opløst stof i forhold til opløsningens volumen eller masse.
-De har en højere molaritet, molalitet og normalitet end fortyndede opløsninger.
-Frysepunktet for koncentrerede opløsninger er lavere end for fortyndede opløsninger; de fryser ved koldere temperaturer.
-En koncentreret opløsning har lavere damptryk end en fortyndet opløsning.
-Koncentrerede opløsninger har et højere kogepunkt end fortyndede opløsninger.
-Sættes i kontakt gennem en semipermeabel membran, vandet flyder fra de fortyndede opløsninger til de koncentrerede opløsninger.
Eksempler på løsninger
Koncentreret
-Honning er en mættet opløsning af sukker. Det er almindeligt at observere forekomsten af omkrystallisation af sukker, hvilket fremgår af lågene i beholderne, der indeholder honningen.
-Havvand, der har en høj koncentration af forskellige salte.
-Urin fra mennesker med svær dehydrering.
-Kulsyreholdigt vand er en mættet opløsning af kuldioxid.
Fortyndet
-Urin fra en person med overdreven vandindtagelse.
-Sved er normalt med lav osmolaritet.
-Mange lægemidler givet i opløsningsform har en lav koncentration.
Referencer
- Wikipedia. (2018). Koncentration. Gendannet fra: es.wikipedia.org
- Falst L. (2018). Koncentration af løsninger: Definition og niveauer. Undersøgelse. Gendannet fra: study.com
- The Chemistry Companion for Middle School Teachers- Prøve. (s.f.). Løsninger og koncentration. [PDF]. Gendannet fra: ice.chem.wisc.edu
- Vandige løsninger - molaritet. Gendannet fra: chem.ucla.edu
- Whitten, Davis, Peck & Stanley. (2008). Kemi. (8. udgave). CENGAGE Læring.

Endnu ingen kommentarer