
Karakteristiske apolære molekyler, identifikation og eksempler
Det apolære molekyler er dem, der præsenterer i deres struktur en symmetrisk fordeling af deres elektroner. Dette er muligt, hvis elektronegativitetsforskellen på deres atomer er lille, eller hvis de elektronegative atomer eller grupper vektorvist annullerer deres virkninger på molekylet..
Ikke altid er "apolaritet" absolut. Af denne grund betragtes molekyler med lav polaritet undertiden som apolare; det vil sige, det har et dipolmoment µ tæt på 0. Her går vi ind i det relative felt: hvor lavt skal µ være for at et molekyle eller en forbindelse kan betragtes som ikke-polær??
For bedre at løse problemet er der bortrifluoridmolekylet, BF3 (øverste billede).
Fluoratomet er meget mere elektronegativt end boratomet, og derfor er BB-bindingerne polære. Imidlertid BF-molekylet3 er symmetrisk (trigonalplan) og involverer vektorannullering af de tre øjeblikke B-F.
Således genereres også apolære molekyler, selv med eksistensen af polære bindinger. Den dannede polaritet kan afbalanceres ved eksistensen af et andet polært led, af samme størrelse som det foregående, men orienteret i den modsatte retning; som det sker i BF3.
Artikelindeks
- 1 Karakteristika for et apolært molekyle
- 1.1 Symmetri
- 1.2 Elektronegativitet
- 1.3 Intermolekylære kræfter
- 2 Sådan identificeres dem?
- 3 eksempler
- 3.1 Ædelgasser
- 3.2 Diatomiske molekyler
- 3.3 Kulbrinter
- 3.4 Andre
- 4 Referencer
Karakteristika for et apolært molekyle
Symmetri
For at virkningerne af polære bindinger kan fjerne hinanden, skal molekylet have en bestemt geometrisk struktur; fx lineær, den letteste at forstå ved første øjekast.
Dette er tilfældet med kuldioxid (COto), som har to polære bindinger (O = C = O). Dette skyldes, at de to dipolmomenter af C = O-bindingerne annulleres, når den ene er orienteret mod den ene side og den anden mod den anden i en vinkel på 180 °..
Derfor er en af de første egenskaber, der skal tages i betragtning, når man vurderer et "molekylers" apolaritet fra et fugleperspektiv, at observere, hvor symmetrisk det er..
Antag, at i stedet for COto vi har COS-molekylet (O = C = S), kaldet carbonylsulfid.
Nu er det ikke længere et apolært molekyle, da svovlens elektronegativitet er mindre end ilt; og derfor er dipolmomentet C = S forskelligt fra det for C = O. Som et resultat er COS et polært molekyle (hvor polar er en anden sag).
Billedet nedenfor opsummerer grafisk alt det netop beskrevne:
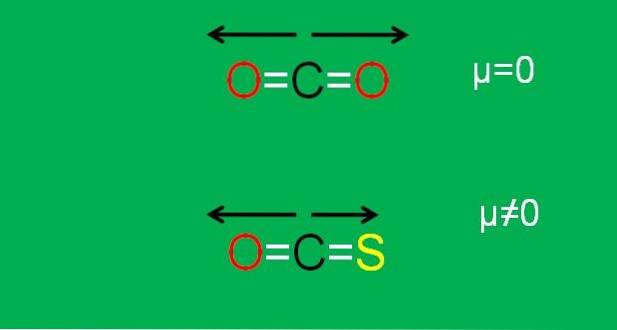
Bemærk, at dipolmomentet for C = S-bindingen er mindre end for C = O-bindingen i COS-molekylet.
Elektronegativitet
Elektronegativitet på Pauling-skalaen har værdier mellem 0,65 (for francium) og 4,0 (for fluor). Generelt har halogener en høj elektronegativitet.
Når forskellen i elektronegativitet for de elementer, der danner en kovalent binding, er mindre end eller lig med 0,4, siges det at være ikke-polær eller ikke-polær. Imidlertid er de eneste molekyler, der virkelig er apolære, dannet af bindinger mellem identiske atomer (såsom hydrogen, H-H)..
Intermolekylære kræfter
For at et stof kan opløses i vand, skal det interagere elektrostatisk med molekylerne; interaktioner, som apolære molekyler ikke kan udføre.
I apolære molekyler er deres elektriske ladninger ikke begrænset til den ene ende af molekylet, men er symmetrisk (eller homogent) fordelt. Derfor er det ude af stand til at interagere med dipol-dipol kræfter.
I stedet interagerer apolære molekyler med hinanden gennem Londons spredningskræfter; Disse er øjeblikkelige dipoler, der polariserer den elektroniske sky af atomerne i nabomolekyler. Her er molekylvægten en dominerende faktor i disse molekylers fysiske egenskaber..
Hvordan man identificerer dem?
-Måske er en af de bedste metoder til at identificere et apolært molekyle dets opløselighed i forskellige polære opløsningsmidler, idet de generelt er dårligt opløselige i dem..
-Generelt er apolære molekyler luftformige. De kan også være at danne ublandbare væsker med vand.
-Ikke-polære faste stoffer er kendetegnet ved at være bløde.
-Spredningskræfterne, der holder dem sammen, er generelt svage. På grund af dette har deres smelte- eller kogepunkter tendens til at være lavere end forbindelser af polær natur..
-Ikke-polære molekyler, især i flydende form, er dårlige ledere af elektricitet, da de mangler en elektrisk nettoladning..
Eksempler
Ædle gasser
Selv om de ikke er molekyler, betragtes ædelgasser som apolare. Hvis det antages, at to af dets atomer, He-He, interagerer i korte perioder, kunne interaktionen betragtes (halv) som et molekyle; molekyle, der ville være apolært.
Diatomiske molekyler
Diatomiske molekyler, såsom Hto, BRto, jegto, Clto, Oto, og Fto, de er apolar. Disse har den generelle formel A.to, A-A.
Kulbrinter
Hvad hvis A var en gruppe af atomer? Det ville være før andre apolære forbindelser; for eksempel ethan, CH3-CH3, hvis kulstofskelet er lineært, C-C.
Methan, CH4, og etan, CtoH6, de er apolære molekyler. Kulstof har en elektronegativitet på 2,55; mens brintens elektronegativitet er 2,2. Derfor er der en dipolvektor med lav intensitet, orienteret fra brint mod kulstof..
Men på grund af den geometriske symmetri af methan- og ethanmolekylerne er summen af dipolvektorerne eller dipolmomenterne i deres molekyler nul, så der er ingen nettoladning på molekylerne..
Generelt sker det samme med alle kulbrinter, og selv når der er umættede i dem (dobbelt- og tredobbeltbindinger), betragtes de som ikke-polære eller lavpolaritetsforbindelser. Cykliske carbonhydrider er også apolære molekyler, såsom cyclohexan eller cyclobutan.
Andre
Molekyler af kuldioxid (COto) og carbondisulfid (CSto) er apolære molekyler, begge med lineær geometri.
I carbondisulfid er kulstofens elektronegativitet 2,55, mens svovlens elektronegativitet er 2,58; så begge elementer har praktisk talt den samme elektronegativitet. Der er ingen generation af en dipolvektor, og nettoladningen er derfor nul.
Ligeledes har vi følgende CCl-molekyler4 og AlBr3, begge apolar:
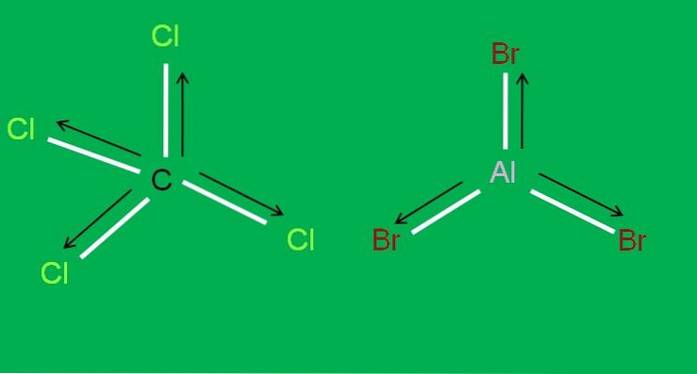
I aluminiumtribromid, AlBr3 det samme sker med BF3, i begyndelsen af artiklen. I mellemtiden, for carbontetrachlorid, CCl4, geometrien er tetraedrisk og symmetrisk, da alle C-Cl-bindinger er ens.
Tilsvarende molekyler med den generelle formel CX4 (CF4, CI4 og CBr4), de er også apolære.
Og endelig kan et apolært molekyle endda have oktaedrisk geometri, som det er tilfældet med svovlhexafluorid, SF6. Faktisk kan den have enhver geometri eller struktur, så længe den er symmetrisk, og dens elektroniske distribution er homogen..
Referencer
- Carey F.A. (2008). Organisk kemi. Carboxylsyrer. (Sjette udgave). Mc Graw Hill.
- Cedrón J., Landa V., Robles J. (2011). Molekylær polaritet. Gendannet fra: corinto.pucp.edu.pe
- Tutor View. (2018). Ikke-polært molekyle. Gendannet fra: chemistry.tutorvista.com
- Helmenstine, Anne Marie, Ph.D. (28. januar 2019). Eksempler på polære og ikke-polære molekyler. Gendannet fra: thoughtco.com
- Kurtus R. (19. september 2016). Polære og ikke-polære molekyler. Skole for mestre. Gendannet fra: school-for-champions.com
- Ganong W. (2004). Medicinsk fysiologi. Udgave 19Th. Redaktionel den moderne manual.



Endnu ingen kommentarer